Oxid zinečnatý
Z Multimediaexpo.cz
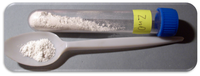
Oxid zinečnatý ZnO je bílá práškovitá látka, nerozpustná ve vodě. Je to nejstarší známá zinková ruda. V přírodě se vyskytuje jako nerost zinkit. Laboratorně se vyrábí nejčastěji rozkladem hydroxidu zinečnatého, průmyslově však spalováním zinku. Největší využití má oxid zinečnatý v malířství jako bílý pigment známý pod názvem zinková běloba.
Obsah |
Základní fyzikálně - chemické vlastnosti
Oxid zinečnatý ZnO je bílá práškovitá látka, nerozpustná ve vodě. Rozpouští se však v zředěných kyselinách a roztocích hydroxidů, jedná se tedy o amfoterní oxid. Oxid zinečnatý krystaluje v šesterečné soustavě nebo tvoří jemný bílý prášek známý v malířství jako zinková běloba. Oxid zinečnatý se rozkládá na kyslík a plynný zinek) při teplotě 1975 °C.
Historický vývoj
První použití oxidu zinečnatého (jako rudy) lze datovat ve starověku, kdy se zinek používal ve slitině s mědí jako mosaz a to již ve starověkém Egyptě okolo roku 1400 př.n.l. nebo Homérově době. Mosaz se získávala tavením mědi se zinkovou rudou, kterou Řekové označovali jako cadmia - časem se z tohoto názvu vyvinul název kalamín, což je nejstarší známá zinková ruda. Místo kalamín se dnes častěji nazývá zinkit.
Výskyt
V přírodě se nachází jako nerost zinkit neboli kalamín či červená ruda zinková.
Výroba
Laboratorní příprava Oxid zinečnatý se dá připravit termickým rozkladem hydroxidu zinečnatého, uhličitanu zinečnatého nebo dusičnanu zinečnatého.
- Zn(OH)2 → ZnO + H2O
- ZnCO3 → ZnO + CO2
- 2 Zn(NO3)2 → 2 ZnO + 4 NO2 + O2
Průmyslová výroba Průmyslová výroba probíhá spalováním zinku.
- 2 Zn + O2 → 2 ZnO
Použití
Používá se jako netoxický bílý pigment při výrobě barviv známých jako zinková běloba. Je součástí gumárenských směsí nutnou při vulkanizaci kaučuku na pryž a nachází uplatnění i v keramickém a sklářském průmyslu při výrobě speciálních chemicky odolných skel a glazur nebo emailů. Oxid zinečnatý je také jeden z meziproduktů při výrobě zinku z rudy sfaleritu.
Literatura
- Dr. Heinrich Remy, Anorganická chemie 2. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 2. díl, 1. vydání 1993 ISBN 80-85427-38-9
| Oxidy s prvkem v oxidačním čísle II. |
|---|
|
Oxid hlinečnatý (AlO) • Oxid barnatý (BaO) • Oxid beryllnatý (BeO) • Oxid kademnatý (CdO) • Oxid vápenatý (CaO) • Oxid uhelnatý (CO) • Oxid kobaltnatý (CoO) • Oxid měďnatý (CuO) • Oxid železnatý (FeO) • Oxid olovnatý (PbO) • Oxid hořečnatý (MgO) • Oxid rtuťnatý (HgO) • Oxid nikelnatý (NiO) • Oxid dusnatý (NO) • Oxid palladnatý (PdO) • |
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |