Methanol
Z Multimediaexpo.cz
Methanol (mimo chemii dle PČP metanol), methylalkohol, karbinol je nejjednodušší alifatický alkohol. Používá se pro něj též dnes již zastaralý název dřevný líh. Je to bezbarvá, alkoholicky páchnoucí kapalina, neomezeně mísitelná s vodou. Je těkavý, hořlavý a silně jedovatý.
Obsah |
Výroba
Původně se vyráběl suchou destilací dřeva, především bukového, přičemž vzniká směs methanolu, kyseliny octové a acetonu. Kyselina octová se ze získané směsi odstraňuje neutralizací vápnem (hydroxidem vápenatým) a methanol spolu s nepatrným množstvím acetonu se oddělí destilací. Podle této metody výroby dostal triviální název dřevný líh. V současné době se průmyslově vyrábí katalytickou hydrogenací oxidu uhelnatého z vodního plynu, tj. směsi vodíku a oxidu uhelnatého za vysokých teplot (250 °C) a tlaků (5 až 10 MPa) a za přítomnosti katalyzátorů na bázi směsi mědi, oxidu zinečnatého a oxidu hlinitého podle rovnice:
- CO + 2 H2 → CH3OH.
Uvedená reakce je vratná; za nižších teplot a tlaků a v přítomností solí trojmocného chromu probíhá opačným směrem.
Vlastnosti
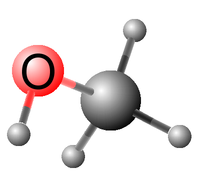
Geometrie molekuly methanolu je zobrazena na obrázku modelu vlevo. Vzhledem k volné otáčivosti částí molekuly kolem σ-vazby mezi uhlíkovým a kyslíkovým atomem se sice může vodík hydroxylové skupiny OH nacházet v libovolné poloze vůči vodíkům methylové skupiny CH3, ale konformace s nejnižší možnou energií je taková, když rovina definovaná vazbami H—O—C právě půlí úhel definovaný trojicí atomů H—C—H methylové skupiny; tato konformace je naznačena na uvedeném obrázku.
Z molekulové hmotnosti methanolu by vyplývalo, že jeho bod varu bude velmi nízký, kolem −170 °C, ve skutečnosti je přibližně +65 °C. Je to způsobeno tím, že atom vodíku hydroxylové skupiny vytváří vodíkovou vazbu s kyslíkem jiné molekuly methanolu. Tím se efektivně zvyšuje molekulová hmotnost této látky a to vede ke zvýšení bodu varu.
Chemické reakce methanolu
Kyslíkem se postupně oxiduje ve třech stupních. V prvním stupni oxidace se přeměňuje na nejjednodušší aldehyd formaldehyd (methanal):
- 2 CH3OH + O2 → 2 CH2O + 2 H2O.
S větším množstvím kyslíku se oxiduje do druhého stupně na kyselinu mravenčí:
- CH3OH + O2 → HCOOH + H2O.
Za velkého přebytku kyslíku se spaluje na oxid uhličitý a vodu:
- 2 CH3OH + 3 O2 → 2 CO2 + 4 H2O.
Tato poslední reakce může probíhat pomalu (např. při působení ultrafialového záření na páry methanolu ve vzduchu, nebo bouřlivě, jako hoření; při hoření vzniká bezbarvý, téměř neviditelný plamen, což může při nepozornosti způsobit vážné popáleniny.
S alkalickými kovy reaguje bouřlivě za vývoje vodíku a vzniku solí, např. methanolátu sodného:
- 2 CH3OH + 2 Na → 2 CH3ONa + H2.
Tyto methanoláty se působením vody okamžitě rozkládají za vzniku methanolu a hydroxidu, např.:
- CH3ONa + H2O → CH3OH + NaOH.
S chloridy karboxylových kyselin vytváří methylestery, např. s chloridem kyseliny octové octan methylnatý, čili methylacetát:
- CH3OH + CH3COCl → CH3COOCH3 + HCl.
Ethanol hoří modrým plamenem, zatímco methanol hoří oranžovým plamenem.
Výskyt v přírodě
Methanol vzniká v malém množství rozkladem organických látek působením některých mikroorganismů (např. oxidací methanu bakteriemi rodu Methylococcus), velice brzy se však ve vzduchu působením slunečního záření oxiduje na oxid uhličitý a vodu.
Fyziologické působení
Methanol se metabolizuje především v játrech, a to pomocí enzymu alkoholdehydrogenázy na formaldehyd. Ten se dále přeměňuje (pomocí aldehyddehydrogenázy a dalších enzymů) na kyselinu mravenčí. Ta se pak oxiduje folátovou metabolickou dráhou na oxid uhličitý. Prokázala se závislost na koncentraci tetrahydrofolátu v játrech - primáti (stejně jako člověk) mají tuto koncentraci výrazně nižší než potkan, proto je i odbourávání kyseliny mravenčí pomalejší.[1]
Toxicita methanolu nespočívá až tolik v působení této látky (byť způsobuje útlum CNS), jako v působení jejích metabolitů. Methanol samotný se metabolizuje zhruba poloviční rychlostí oproti ethanolu. Celková eliminace methanolu je pomalá, odpovídá zhruba sedmině rychlosti pro ethanol. Navíc má ethanol asi dvacetkrát vyšší afinitu k alkoholdehydrogenáze než methanol, proto je preferovaným substrátem. To umožňuje podávat ethanol (nebo též fomepizol) jako antidotum při intoxikaci, protože se výrazně zpomalí metabolismus methanolu a podstatně se tak sníží jeho biochemické a klinické účinky.[1]
Hlavním rizikem při intoxikaci methanolem je metabolická acidóza se zvětšeným anionovým oknem. Je způsobena hromaděním kyseliny mravenčí a v pozdější fázi také kyseliny mléčné. Dochází k útlumu centrálního nervového systému. Dosud neobjasněným mechanismem (pravděpodobně působením kyseliny mravenčí) se poškozuje sítnice, může dojít k trvalé úplné slepotě.[1]
K časným příznakům otravy patří opilost a ospalost. Po 8 až 36 hodinách se přidávají bolesti hlavy, závratě, kóma, případně křeče. Zřítelnice jsou roztažené, s pomalou nebo žádnou reakcí na světlo. Zrak je zhoršený nebo rozmazaný, může zůstat na úrovni vnímání světla nebo může nastat úplná slepota. V akutní fázi je běžné překrvení čočky. Běžně se vyskytují bolesti břicha, občas akutní pankreatitida.[1]
Methanol se snadno vstřebává všemi cestami, tedy především z trávicího traktu, vdechováním nebo přes kůži. Již požití dávek 4 - 10 cm3 může způsobit trvalou slepotu. Individuální rozdíly ve vnímavosti jsou značné, byla hlášena přežití i po dávkách 500-600 cm3 (možná i díky současném používání ethanolu). Při hromadné otravě po požití falšovaného vína (v roce 1986 v Itálii) bylo zjištěno, že při hladinách pod 200 mg/dm3 kyseliny mravenčí v moči se nevyvinuly žádné příznaky ani klinické projevy intoxikace.[1]
Použití
Methanol má širokou škálu použití, mj. jako:
- rozpouštědlo
- přísada do nemrznoucích směsí
- denaturační činidlo pro denaturaci ethanolu (už se prakticky nepoužívá)
- přísada do pohonných látek nebo jako samostatná pohonná látka (zejména u přeplňovaných spalovacích motorů)
- jako surovina pro výrobu jiných organických látek, např.:
- formaldehydy
- kyseliny mravenčí
- dimethylether (ekologický hnací plyn pro aerosolové spreje)
- methyl-terc.-butylether (MTBE, aditivum do benzinu; v současné době se pro karcinogenicitu přestává používat).
Výhledově se uvažuje i o jeho použití v palivových článcích.
Historická poznámka
Methanol znali již staří Egypťané, kteří používali dřevný líh, připravený destilací dřeva, jako jednu z látek při balzamování mumií. V moderní době jej v čisté formě připravil v roce 1661 Robert Boyle, který je nazval spiritus buxi (tedy „duch zimostrázu“), protože jej připravil suchou destilací dřeva zimostrázu. Jeho objev upadl téměř v zapomnění a methanol byl znovuobjeven počátkem 19. století (v roce 1812 Phillipe Taylorem). V roce 1834 francouzští chemikové Jean-Baptiste Dumas a Eugene Peligot určili jeho chemické složení. Moderní metodu výroby z vodního plynu objevil v roce 1923 německý chemik Matthias Pier.
V době 2. světové války se v okupované Střední Evropě - i u nás - používal pro nedostatek benzínu u civilních automobilů pohon na tzv. dřevoplyn, vyráběný v generátorech suchou destilací bukového dřeva; hlavní složkou dřevoplynu byl právě methanol.
Reference
- ↑ 1,0 1,1 1,2 1,3 1,4 Methanol - International Programme on Chemical Safety - Poisons Information Monograph 335
Literatura
- Encyklopedie CoJeCo, http://www.cojeco.cz
- Fyzikální a matematické tabulky 1980 (04-007-80)
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |