Mitochondrie
Z Multimediaexpo.cz
(transmisní elektronový mikroskop)
Mitochondrie je semiautonomní, membránou obalená organela, kterou lze nalézt u většiny eukaryotických buněk. Dosahuje obvykle rozměrů v řádu několika mikrometrů a v buňce se jich může vyskytovat několik stovek, ale i sto tisíc. Jejich funkce se dá přirovnat k buněčné elektrárně, jelikož v nich díky procesu buněčného dýchání vzniká energeticky bohatý adenosintrifosfát (ATP) používaný jako „zdroj energie“ pro průběh jiných reakcí v celé buňce. Navíc se mitochondrie podílejí na dalších procesech, jako je buněčná diferenciace, buněčná smrt i kontrola buněčného cyklu a růstu.[1] Na druhou stranu mohou mít poruchy jejich funkce za následek různá mitochondriální onemocnění.
Některé vlastnosti mitochondrií je činí unikátními. V mnohých ohledech totiž připomínají bakterie; dnes je známo, že se ve skutečnosti opravdu před miliardami let vyvinuly z bakteriálních předků. Uvnitř mitochondrie, jež je uzavřena dvěma membránami, se nachází stále zachovalá mitochondriální DNA, která se v mnohém podobá té bakteriální. Co se týče biochemické stavby, v mitochondriích bylo identifikováno několik stovek proteinů (např. v mitochondriích v srdci se toto číslo odhaduje na 615[2]).
Obsah |
Historie výzkumu
Spolu s rozvojem mikroskopie byly v buňkách identifikovány různé struktury, o nichž se až později zjistilo, že představují jediný typ organely, tedy mitochondrii. Pro tyto různě vypadající struktury bylo používáno nespočetné množství různých termínů, jako například chondriozom, chondrioplast, fuchsinofilní či parabazální tělísko a podobně. Obvykle byla tato slova odvozena z řeckého výrazu pro zrno (χόνδρος, „chondros“), případně z jeho anglického („grain“) a německého („Korn“) ekvivalentu. Se zlepšením pozorovacích metod se na konci 19. století ukázalo, že tyto struktury mohou nabývat i vláknitého tvaru (vlákno je řecky μίτος, tedy „mitos“), a výrazy chondros a mitos daly společně vzniknout složenině, slovu mitochondrie.[3]
V letech 1912–1913 B.F. Kingsbury a O. Warburg prokázali, že mitochondrie jsou sídlem energetického metabolismu eukaryotické buňky. Detaily složitých procesů odehrávajících se v nitru mitochondrie však byly odhalovány postupně (Hans Adolf Krebs, 1937 – Krebsův cyklus) a k poznání přispěl zejména rozvoj izolace jednotlivých enzymů. Postupně byly odhalovány podrobnější informace o stavbě mitochondrií, například skutečnost, že jsou obaleny dvěma membránami, nebo v roce 1963 i existence mitochondriální DNA.[3]
Evoluční původ
- Podrobnější informace naleznete na stránce: eukaryogeneze
V dnešní době je obecně akceptováno, že mitochondrie představují potomky endosymbiotické bakterie, které se v procesu vzniku eukaryotické buňky určitým způsobem transformovala v semiautonomní organelu.[3][4] Předpokládá se, že touto bakterií, která vstoupila do primitivní eukaryotické buňky, byl zástupce alfaproteobakterií z příbuzenského okruhu rodu Rickettsia.[5] Tyto názory však byly odbornou veřejností poměrně dlouho odmítány jako „nehodící se do slušné přírodovědné společnosti“.[3] První představy o takovém původu se však paradoxně začaly objevovat již na konci 19. století, kdy ještě ani nebyl ustanoven termín mitochondrie (např. Richard Altmann, 1890). Známými zastánci této tzv. endosymbiotické teorie byl na začátku 20. století Konstantin Merežkovskij, případně v druhé polovině 20. století Lynn Margulisová.[3]
Přesný scénář „endosymbiotické události“, tedy procesu, při němž se bakterie fakticky změnila na mitochondrii, je stále poměrně zahalen tajemstvím. Podle tzv. molekulárních hodin (metoda založená na pozorování mutací v DNA) se zdá, že k tomu došlo přibližně před 2 miliardami lety, tedy zřejmě nedlouho po vzniku samotné eukaryotické buňky.[6] Dnes se také považuje za prokázané, že všechny známé eukaryotické organizmy buď mitochondrii mají, nebo alespoň měly za předka eukaryonta, který mitochondrii měl. Proto se dnes ustupuje od termínu Archezoa, který označoval skupiny eukaryot, jež vznikly ještě před „endosymbiotickou událostí“: žádné takové nebyly objeveny.[5] Zřejmé je také to, že mitochondrie vznikla v historii jednou jedinkrát, a všechny současné mitochondrie jsou potomky této události (mluví se o tzv. monofyletickém původu).[3]
Konkrétní scénář poskytují například známé vodíkové hypotézy, které jsou v podstatě všechny založené na předpokladu, že hostitelskou buňkou byla anaerobní, vodík metabolizující autotrofní archebakterie, která jistým způsobem pohltila symbiotickou bakterii schopnou v rámci své respirace produkovat vodík. Tyto bakterie následně prošly evolucí a změnily se na mitochondrie.[7][8] Ať už to bylo tak, či onak, po endosymbiotické události muselo zcela jistě dojít k částečné redukci genomu symbiotické bakterie a pravděpodobně také k tzv. horizontálnímu transferu, tedy přechodu části genů z mitochondrie do jádra.
Redukce mitochondrií
Ačkoliv všechny současné známé eukaryotické organizmy pochází ze společného předka, který mitochondrii měl, u mnohých eukaryot byly místo mitochondrií popsány jen jakési redukované organely neschopné oxidativní fosforylace, jako jsou hydrogenozomy a mitozomy. Tyto organely jsou často schopné syntézy ATP bez přítomnosti kyslíku, a hodí se tedy do anaerobního prostředí. Hydrogenozomy a mitozomy byly popsány zejména (ne však výhradně) v říších Excavata a Amoebozoa, známé jsou například Entamoeba histolytica, Giardia intestinalis, různé mikrosporidie (Microsporidia) a chytridiomycety (Chytridiomycota), případně různí anaerobní nálevníci (Ciliophora). U některých eukaryot však prozatím nebyly popsány ani mitochondrie, ani žádné jiné organely tohoto typu.[9]
Stavba
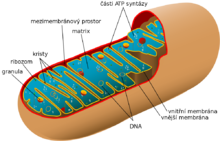
Mitochondrie mohou mít velice rozmanité prostorové uspořádání a velikost, sahající od vláknité struktury až po kompaktní zrna. Například v hepatocytech a fibroblastech mají klobásovitý tvar a rozměry 3–4 μm na délku a 1 μm na šířku.[3] Tím také připomínají bakterie (např. E. coli dosahuje délky 2–3 μm a šířky 0,6 μm.[10]) Co se týče počtu, v hepatocytech se obvykle nachází asi 800 mitochondrií, lidský oocyt jich však obsahuje až 100 000, měňavka Chaos chaos dokonce 500 000, ale např. lidská spermie jen několik[3] a Trypanosoma jen jednu.[11] Mitochondrie se množí procesem podobným binárnímu dělení bakterií, může však docházet i opačnému procesu, tedy fúzi dvou mitochondrií dohromady.[12]
Membrány
Mitochondrie je, podobně jako například primární plastidy, oddělena od okolí dvěma fosfolipidovými membránami, mezi nimiž je tzv. mezimembránový prostor. Takový systém je srovnatelný se stavbou membrány gramnegativních bakterií, z nichž se mitochondrie vyvinuly.[13] Mezimembránový prostor má složení velice podobné složení okolního cytosolu, tzn. obsahuje mnohem méně proteinů, než vnitřní mitochondriální prostor (tzv. matrix). Z bílkovin je v mezimembránovém prostoru zastoupen hlavně cytochrom c a různé kinázy.
Vnější membrána mitochondrií představuje první bariéru mezi vnitřním prostředím organely a okolním cytosolem. Je v úzkém kontaktu s endoplazmatickým retikulem, a do jisté míry se mu podobá i svou stavbou. Obsahuje však ve své ploše mnoho pórů (mitochondriální poriny VDAC), a tak je tato membrána propustná pro většinu látek s molekulovou hmotností nepřesahující přibližně 5000 Da[14] (někdy se uvádí i 10 000 Da[15]). Proto zamezuje spíše jen vstupu bílkovin a jiných makromolekul. To je významné především ze dvou hledisek: kdyby byly póry větší, nejen, že by unikly z mezimembránového prostoru důležité proteiny dýchacího řetězce, ale uvolněním cytochromu c by se navíc nastartovala v buňce programovaná buněčná smrt. Přesto se proteiny transportovat musí, a tak vnější membrána obsahuje tzv. Tom komplex, který je přenáší z cytoplazmy do intermembránového prostoru. Dále se na vnější membrány nachází enzymy, které jsou součástí metabolismu mastných kyselin a fosfolipidů.[14]
Vnitřní membrána má velkou plochu, protože je zvlněna v tzv kristy. U jaterních buněk, které mají kristy ještě relativně malé, je plocha vnitřní membrány mitochondrie 15× větší než plocha plazmatické membrány buňky.[15] Obecně závisí velikost krist na metabolické aktivitě konkrétní buňky.[15] Vnější membrána je zásadní z hlediska funkčnosti mitochondrie. Je schopná propouštět molekuly jen velice selektivně, ionty přes ní téměř nedifundují, a to možná díky speciální stavbě fosfolipidové dvouvrstvy. Obsahuje totiž neobvyklý fosfolipid kardiolipin, z jehož fosfátové hlavy vychází ne dvě, ale hned čtyři mastné kyseliny.[16] Na této membráně je totiž umístěno množství enzymů tzv. dýchacího řetězce, včetně ATP syntázy a enzymu ANT, který vynáší konečný produkt dýchání – adenosintrifosfát – ven do buňky. Dále obsahuje vnitřní membrána (podobně jako ta vnější) komplex, který umožňuje přenos bílkovin přes ní – ten se označuje jako Tim komplex.[14]
Matrix
Uvnitř mitochondrie se nachází matrix, hustá hmota s obsahem vody méně než 50%,[15] velice bohatá na bílkoviny. Patří k nim zejména enzymy Krebsova cyklu. Dále matrix obsahuje různé nukleotidové koenzymy, anorganické ionty (vápník), z větších struktur mitochondriální DNA, příslušnou RNA a dokonce mitochondriální ribozomy (ve shodě s endosymbiotickou teorií jsou velice podobné ribozomům bakteriálním[13]).
Funkce
Buněčné dýchání a syntéza ATP
V mitochondriích probíhá převážná část buněčného dýchání (vyjma zejména glykolýzy, jež probíhá v cytosolu). Tento sled reakcí představuje rozklad různých organických látek, čímž se získává energie potřebná pro syntézu adenosintrifosfátu (ATP). Výchozí látkou jsou zejména pyruvát a mastné kyseliny, obě látky v mitochondriální matrix prochází reakcemi, při nichž vzniká acetylkoenzym A (pyruvát prochází dekarboxylací, mastné kyseliny beta-oxidací). Acetylkoenzym A následně vstupuje do Krebsova cyklu, což je série reakcí, které umožňují redukci koenzymů NAD+ na NADH a FAD na FADH2. Elektrony z těchto koenzymů jsou předávány do dýchacího řetězce, jenž je umístěn na vnitřní membráně mitochondrie. Dýchací řetězec přenáší do mezimembránového prostoru vodíkové kationty (H+, čímž vzniká v prostoru mezi membránami kyselé pH. Toto pH má tendenci se vyrovnávat, a tak prochází otvorem v enzymu ATP syntáze zpět dovnitř buňky. Průchodem H+ však tento enzym vytváří ATP, jež je kýženým produktem celého sledu reakcí.[16]
Další funkce
Přestože je mitochondrie známá převážně jako energetická jednotka buňky, byly k ní přiřazeny i další důležité funkce. S buněčným dýcháním souvisí skutečnost, že jsou mitochondrie v hnědé tukové tkáni schopné produkovat teplo. Mechanismus je elegantní: místo toho, aby vodíkové kationty procházely ATP syntázou, prochází protonovým kanálem termogeninem (UCP1), jenž je právě zodpovědný za vznik tepelné energie.[17][18]
Navíc může matrix mitochondrií fungovat jako zásobárna vápníku (podobně jako endoplazmatické retikulum), čímž udržují vnitřní homeostázu buňky. Dovnitř se dostávají ionty vápníku speciálním přenašečem, který je poháněn membránovým potenciálem,[19][20] při masivním uvolňování vápníku ven se může tímto způsobem navodit v buňce určitá odpověď (produkce hormonů, neurotransmiterů, atp). Navíc je v mitochondrii přítomna řada proteinů spouštějících apoptózu, programovanou buněčnou smrt buňky,[21] regulace buněčné proliferace a metabolismu,[1] probíhají však v nich i některé části syntézy hemu[22] a steroidů.[23]
Je známo, že jsou v mitochondriích (jako vedlejší produkt buněčného dýchání) produkovány kyslíkové radikály, jež mohou způsobit četné mutace v mitochondriální DNA.[24] Čím více je tato DNA poškozována, tím defektnější molekuly vznikají, a tím spíš se pak mohou degenerativní změny prohlubovat. Množství změn je v mitochondriích pozorováno během lidského stárnutí.[25] Některé změny mohou být dávány do souvislosti s Parkinsonovou chorobou.[26]
Genetická informace
- Podrobnější informace naleznete na stránce: mitochondriální DNA
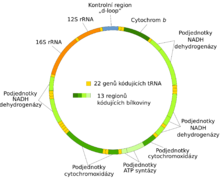
Mitochondriální DNA (též mtDNA) je označení pro DNA, která se nachází v mitochondriích a tvoří tak součást mimojaderné genetické informace. Jedná se o pozůstatek genomu bakterií, z nichž mitochondrie vznikla, a dodnes s nimi má mnoho společných rysů.[5] Mitochondriální DNA je totiž zpravidla kruhová (cirkulární) a svým charakterem se podobá prokaryotnímu nukleoidu a nikoliv eukaryotickým chromozomům. Je v porovnání s jaderným genomem velice malá. Například lidská mitochondriální DNA má velikost 16 569 párů bazí,[16] celkem obsahuje 37 genů, z toho 24 představují geny pro různou nekódující RNA (2 geny pro 16S a 23S rRNA a 22 genů pro tRNA). Zbývajících 13 genů kóduje vlastní mitochondriální polypeptidy podílející se na enzymatické výbavě mitochondrií.[27] Na druhou stranu může být mtDNA v mitochondrii přítomná v několika kopiích a s přihlédnutím ke skutečnosti, že mitochondrií může být v buňce i několik set tisíc, může paradoxně představovat genom v mitochondrii většinovou složku celkového buněčného genomu.[16]
Mitochondriální DNA se dědí obvykle po matce, tedy maternálně, jelikož z vajíčka (a nikoliv ze spermie) pochází obvykle veškerá mitochondriální genetická informace zárodku.[16] To je také jeden z důvodů, proč je mtDNA velci cenným nástrojem genetiků a molekulárních biologů – geny matky a otce se nerekombinují. Navíc mtDNA mutuje rychleji než jaderný genom, čímž umožňuje zkoumat změny v mnohem kratším časovém měřítku. Tyto a další vlastnosti mtDNA umožňují zkoumat například migrace lidských populací (viz termín mitochondriální Eva).[3]
Poruchy a onemocnění
- Podrobnější informace naleznete na stránce: mitochondriální onemocnění
Mitochondriální onemocnění je označení pro takové onemocnění, které je způsobené poruchou funkce mitochondrií, a to v širším významu jak vrozené, tak i získané. Za vrozené se považují onemocnění způsobené mutacemi v genech v jaderné DNA či v mitochondriální DNA). Naopak získané poruchy mitochondrií mohou být výsledkem infekce, užívání léků či vlivem negativních podmínek prostředí.[28] Obvykle se jedná o onemocnění způsobená poruchami v mitochondriálním metabolismu, zejména poruchy oxidativní fosforylace.[29]
Poznámky
Reference
- ↑ 1,0 1,1 McBride HM, Neuspiel M, Wasiak S. Mitochondria: more than just a powerhouse. Curr Biol., červenec 2006, roč. 16, čís. 14, s. R551–60. Dostupné online. DOI:10.1016/j.cub.2006.06.054. PMID 16860735.
- ↑ Taylor SW, Fahy E, Zhang B, Glenn GM, Warnock DE, Wiley S, Murphy AN, Gaucher SP, Capaldi RA, Gibson BW, Ghosh SS. Characterization of the human heart mitochondrial proteome. Nat Biotechnol., březen 2003, roč. 21, čís. 3, s. 281–6. DOI:10.1038/nbt793. PMID 12592411.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 SCHEFFLER, Immo E.. Mitochondria. [s.l.] : John Wiley & Sons, Inc., 1999. ISBN 0-471-19422-0.
- ↑ GRAY, M. W.. The endosymbiont hypothesis revisited. International Review of Cytology, 1992, roč. 141, s. 233-357. Dostupné online. ISSN 0074-7696.
- ↑ 5,0 5,1 5,2 EMELYANOV, Victor V. Mitochondrial connection to the origin of the eukaryotic cell. European Journal of Biochemistry, roč. 270, čís. 8, s. 1599-1618. Dostupné online. (anglicky)
- ↑ HAMPL, Vladimír. Eukaryogeneze (PROTISTOLOGIE 2008) [online]. . Dostupné online.
- ↑ Martin W, Müller M. The hydrogen hypothesis for the first eukaryote. Nature, Mar 1998, čís. 392, s. 37-41. DOI:10.1038/32033. PMID 9510239. (anglicky)
- ↑ MOREIRA, Lopez-Garcia Symbiosis between methanogenic archaea and delta-proteobacteria as the origin of eukaryotes: the syntrophic hypothesis. Journal of Molecular Evolution, 1998-11, roč. 47, čís. 5, s. 517-30. Dostupné online. ISSN 0022-2844. DOI:9797402.
- ↑ TACHEZY, Jan. Hydrogenosomes and Mitosomes: Mitochondria of Anaerobic Eukaryotes. [s.l.] : Springer, 2008. ISBN 3540767320. S. 287.
- ↑ Toxicon - Escherichia coli [online]. . Dostupné online.
- ↑ KUBIŠTA, Václav. Buněčné základy životních dějů. Praha : Scientia, 1998. ISBN 80-7183-109-3. S. 210.
- ↑ ALBERTS, Bruce, et al Essential Cell Biology. 2. vyd. New York : Garland Science, 2004.
- ↑ 13,0 13,1 ROBINSON, Richard. Reference Biology. New York : Thomson Gale, 2002. ISBN 0-02-86551-6.
- ↑ 14,0 14,1 14,2 Lennarz,W.J., Lane, M.D.. ENCYCLOPEDIA OF BIOLOGICAL CHEMISTRY, FOUR-VOLUME SET, 1-4. [s.l.] : [s.n.].
- ↑ 15,0 15,1 15,2 15,3 VOET, Donald; VOET, Judith. Biochemie. 1.. vyd. Praha : Victoria Publishing, 1995. ISBN 80-85605-44-9.
- ↑ 16,0 16,1 16,2 16,3 16,4 Alberts, Bruce , et al.. The Molecular Biology of the Cell. [s.l.] : Garland Science, 2002. (4th. ed.) Dostupné online. ISBN 0-8153-3218-1. Kapitola Energy Conversion: Mitochondria and Chloroplasts.
- ↑ Mozo J, Emre Y, Bouillaud F, Ricquier D, Criscuolo F. Thermoregulation: What Role for UCPs in Mammals and Birds?. Bioscience Reports., listopad 2005, roč. 25, s. 227–249. DOI:10.1007/s10540-005-2887-4.
- ↑ Nicholls DG, Lindberg O. Brown-adipose-tissue mitochondria. The influence of albumin and nucleotides on passive ion permeabilities. Eur. J. Biochem., 1973, roč. 37, s. R551. DOI:10.1111/j.1432-1033.1973.tb03014.x. PMID 4777251.
- ↑ Miller RJ. Mitochondria – the kraken wakes!. Trends in Neurosci., 1998, roč. 21, čís. 3, s. 95–97 doi=10.1016/S0166–2236(97)01206–X.
- ↑ Siegel GJ, Agranoff BW, Fisher SK, Albers RW, Uhler MD. Basic Neurochemistry. 6. vyd. [s.l.] : Lippincott Williams & Wilkins, 1999. ISBN 0-397-51820-X.
- ↑ Green DR. Apoptotic pathways: the roads to ruin. Cell., září 1998, roč. 94, čís. 6, s. 695–8. DOI:10.1016/S0092-8674(00)81728-6. PMID 9753316.
- ↑ OH-HAMA, T. Evolutionary consideration on 5-aminolevulinate synthase in nature. Orig Life Evol Biosph., srpen 1997, roč. 27, čís. 4, s. 405–12. DOI:10.1023/A:1006583601341. PMID 9249985.
- ↑ ROSSIER, M. F. T channels and steroid biosynthesis: in search of a link with mitochondria. Cell Calcium., 2006, roč. 40, čís. 2, s. 155–64. DOI:10.1016/j.ceca.2006.04.020. PMID 16759697.
- ↑ Richter C, Park J, Ames BN. Normal Oxidative Damage to Mitochondrial and Nuclear DNA is Extensive. PNAS, 1988 September, roč. 85, čís. 17, s. 6465–6467. DOI:10.1073/pnas.85.17.6465. PMID 3413108.
- ↑ Mitochondria and Aging. [online]. . Dostupné online.
- ↑ Bender A, Krishnan KJ, Morris CM, Taylor GA, Reeve AK, Perry RH, Jaros E, Hersheson JS, Betts J, Klopstock T, Taylor RW, Turnbull DM. High levels of mitochondrial DNA deletions in substantia nigra neurons in aging and Parkinson disease. Nat Gen., 2006, roč. 38, s. 515–517. DOI:10.1038/ng1769. PMID 16604074.
- ↑ The Report of the Committee on the Human Mitochondrial Genome, http://www.mitomap.org/report.html
- ↑ Mitochondrial Diseases [online]. National Library of Medicine - Medical Subject Headings. Dostupné online.
- ↑ ZEVIANI, Massimo; DI DONATO, Stefano. Mitochondrial disorders. Brain, 2004-10-01, roč. 127, čís. 10, s. 2153-2172. Dostupné online. DOI:10.1093/brain/awh259.
Externí odkazy
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |