a opravdu velká série soutěží o nejlepší webovou stránku !!
Proto neváhejte a začněte hned zítra soutěžit o lákavé ceny !!
Methan
Z Multimediaexpo.cz
m (1 revizi) |
(+ Vylepšení) |
||
| Řádka 33: | Řádka 33: | ||
|Reaktivita=0 | |Reaktivita=0 | ||
|Ostatní rizika=}} | |Ostatní rizika=}} | ||
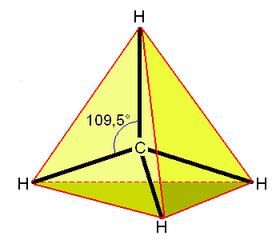
| - | }} | + | }}[[Soubor:Methan_geom2.PNG|thumb|280px|Geometrie molekuly methanu. Červenými linkami naznačen opsaný čtyřstěn.]] |
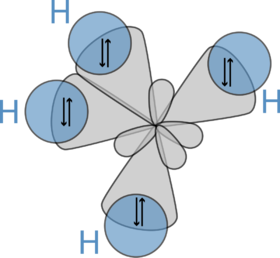
| - | [[Soubor:Methan_geom2.PNG|thumb| | + | [[Soubor:Ch4 hybridization.png|thumb|280px|3D model methanu]] |
| - | [[Soubor:Ch4 | + | '''Methan''' (mimo chemii dle [[PČP]] '''metan''') neboli podle systematického názvosloví '''karban''' je nejjednodušší [[alkany|alkan]] a tedy i nejjednodušší [[uhlovodíky|uhlovodík]] vůbec. Při pokojové teplotě je to netoxický [[plyn]] bez barvy a zápachu, lehčí než vzduch (relativní hustota 0,55 při 20 °C). |
| - | '''Methan''' (mimo chemii dle [[PČP]] '''metan''') neboli podle systematického názvosloví '''karban''' je nejjednodušší [[alkany|alkan]] a tedy i nejjednodušší [[uhlovodíky|uhlovodík]] vůbec. Při pokojové teplotě je to netoxický [[plyn]] bez barvy a zápachu, lehčí než vzduch (relativní hustota 0,55 při 20 °C). | + | |
== Příprava == | == Příprava == | ||
Hlavním zdrojem methanu je přírodní surovina [[zemní plyn]]. Přímá příprava sloučením [[uhlík]]u s [[vodík]]em je prakticky nemožná, vzhledem k tomu, že by uhlík musel být nejprve převeden do plynného stavu. Teoreticky však lze methan připravit dvoustupňovou syntézou přes [[sirouhlík]] | Hlavním zdrojem methanu je přírodní surovina [[zemní plyn]]. Přímá příprava sloučením [[uhlík]]u s [[vodík]]em je prakticky nemožná, vzhledem k tomu, že by uhlík musel být nejprve převeden do plynného stavu. Teoreticky však lze methan připravit dvoustupňovou syntézou přes [[sirouhlík]] | ||
| Řádka 57: | Řádka 56: | ||
: CHCl<sub>3</sub> + Cl<sub>2</sub> → CCl<sub>4</sub> + HCl. | : CHCl<sub>3</sub> + Cl<sub>2</sub> → CCl<sub>4</sub> + HCl. | ||
Podobně reaguje i s jinými [[halogen]]y. Jinak je málo reaktivní. | Podobně reaguje i s jinými [[halogen]]y. Jinak je málo reaktivní. | ||
| - | ;Dokonalé hoření methanu | + | ; Dokonalé hoření methanu |
CH<sub>4</sub> + 2O<sub>2</sub> → CO<sub>2</sub> + 2H<sub>2</sub>O | CH<sub>4</sub> + 2O<sub>2</sub> → CO<sub>2</sub> + 2H<sub>2</sub>O | ||
| - | ;Nedokonalé hoření methanu | + | {{RIGHTTOC}} |
| + | ; Nedokonalé hoření methanu | ||
CH<sub>4</sub> + O<sub>2</sub> → 2H<sub>2</sub>O + C | CH<sub>4</sub> + O<sub>2</sub> → 2H<sub>2</sub>O + C | ||
nebo 2CH<sub>4</sub> + 3O<sub>2</sub> → 4H<sub>2</sub>O + 2CO | nebo 2CH<sub>4</sub> + 3O<sub>2</sub> → 4H<sub>2</sub>O + 2CO | ||
| Řádka 101: | Řádka 101: | ||
V chemickém průmyslu se používá především k výrobě [[oxid uhličitý|oxidu uhličitého]] spalováním se vzduchem a při neúplném spalování k výrobě sazí, používaných jako plnidlo a barvivo v gumárenském průmyslu. | V chemickém průmyslu se používá především k výrobě [[oxid uhličitý|oxidu uhličitého]] spalováním se vzduchem a při neúplném spalování k výrobě sazí, používaných jako plnidlo a barvivo v gumárenském průmyslu. | ||
== Ekologické účinky == | == Ekologické účinky == | ||
| - | Vzhledem k tomu, že silně absorbuje [[infračervené záření]], patří mezi významné [[ | + | Vzhledem k tomu, že silně absorbuje [[infračervené záření]], patří mezi významné [[Skleníkové plyny|skleníkové plyny]] zvyšující teplotu zemské atmosféry (je přibližně 20× účinnější než [[oxid uhličitý]]),jeho obsah v atmosféře je asi devětkrát menší než u oxidu uhličitého (0,004% methanu a 0,037% oxidu uhličitého).<ref group=pozn.> |
| - | Pro přehled účinnosti skleníkových plynů viz tabulka v hesle [[ | + | Pro přehled účinnosti skleníkových plynů viz tabulka v hesle [[Skleníkové plyny]] |
</ref> | </ref> | ||
| Řádka 120: | Řádka 120: | ||
| - | {{Commonscat|Methane}}{{Fosilní paliva}}{{Článek z Wikipedie}} | + | {{Flickr|Methane}}{{Commonscat|Methane}}{{Fosilní paliva}}{{Článek z Wikipedie}} |
[[Kategorie:Alkany]] | [[Kategorie:Alkany]] | ||
[[Kategorie:Bioplyn]] | [[Kategorie:Bioplyn]] | ||
[[Kategorie:Zemní plyn]] | [[Kategorie:Zemní plyn]] | ||
[[Kategorie:Skleníkové plyny]] | [[Kategorie:Skleníkové plyny]] | ||
Aktuální verze z 20. 10. 2018, 16:41
Methan (mimo chemii dle PČP metan) neboli podle systematického názvosloví karban je nejjednodušší alkan a tedy i nejjednodušší uhlovodík vůbec. Při pokojové teplotě je to netoxický plyn bez barvy a zápachu, lehčí než vzduch (relativní hustota 0,55 při 20 °C).
Příprava
Hlavním zdrojem methanu je přírodní surovina zemní plyn. Přímá příprava sloučením uhlíku s vodíkem je prakticky nemožná, vzhledem k tomu, že by uhlík musel být nejprve převeden do plynného stavu. Teoreticky však lze methan připravit dvoustupňovou syntézou přes sirouhlík
- C + 2 S → CS2,
který pak reakcí se sulfanem (sirovodíkem) a mědí dá methan
- CS2 + 2 H2S + 8 Cu → CH4 + 4 Cu2S.
Jinou možností je reakce karbidu hliníku s vodou
- Al4C3 + 12 H2O → 3 CH4 + 4 Al(OH)3.
Laboratorně se dá připravit žíháním směsi octanu sodného s hydroxidem sodným (natronovým vápnem)
- CH3COONa + NaOH → CH4 + Na2CO3.
Vlastnosti
Molekula methanu má symetrii pravidelného čtyřstěnu (bodová grupa symetrie Td), v jehož těžišti se nachází uhlíkový atom a v jehož vrcholech se nacházejí vodíkové atomy. Díky této vysoké symetrii je celkově molekula methanu nepolární, přestože vazby H–C slabou polaritu vykazují. Methan může reagovat explozivně s kyslíkem
- CH4 + 2 O2 → CO2 + 2 H2O.
Bod samozážehu je sice velmi vysoký (595 °C, teplota vznícení při koncentraci 8,5 % je 537 °C), ale stačí např. elektrická jiskra nebo otevřený plamen a směs methanu se vzduchem může být přivedena k výbuchu (minimální iniciační energie je 0,28 mJ). Přitom meze výbušnosti jsou značně velké, od 4,4 do 15 objemových procent. Proto je nezbytně nutné průběžně sledovat koncentraci methanu (důlního plynu) v uhelných dolech, aby se předešlo katastrofám. Podobně prudce může methan reagovat i s plynným chlórem, je-li reakce iniciována prudkým zahřátím. Za normální teploty probíhá pomalu čtyřstupňově za vzniku chlorovaných derivátů methanu
- CH4 + Cl2 → CH3Cl + HCl,
- CH3Cl + Cl2 → CH2Cl2 + HCl,
- CH2Cl2 + Cl2 → CHCl3 + HCl,
- CHCl3 + Cl2 → CCl4 + HCl.
Podobně reaguje i s jinými halogeny. Jinak je málo reaktivní.
- Dokonalé hoření methanu
CH4 + 2O2 → CO2 + 2H2O
Obsah |
- Nedokonalé hoření methanu
CH4 + O2 → 2H2O + C nebo 2CH4 + 3O2 → 4H2O + 2CO
Výskyt v přírodě
Methan se přirozeně vyskytuje na Zemi:
- v atmosféře, kam se dostává zejména jako produkt rozkladu látek biogenního původu (bioplyn), nebo jako produkt metabolismu velkých přežvýkavců, také z termitišť a z rýžovišť.
- v podzemí:
- jako hlavní složka zemního plynu
- jako součást důlního plynu v dolech
- rozpuštěný v ropě
- rozpuštěný ve vodě některých jezer, zvláště v Africe (např. jezero Kivu mezi Rwandou a Kongem)
- tvoří bublinky pod ledem rozmrzajícího permafrostu, například na Sibiři
Přítomnost ve vesmíru
Ve vesmíru byl nalezen v plynných mračnech v mezihvězdném prostoru. Dále pak je součástí atmosfér velkých planet (Jupiter, Saturn, Uran a Neptun) sluneční soustavy. V pevném stavu je součástí tzv. ledových měsíců velkých planet a tvoří zřejmě nezanedbatelnou část hmoty transneptunických těles, případně je vysrážen ve formě ledu nebo jinovatky na jejich povrchu (např. Pluto). Byl také prokázán v komách komet.
Původ na Zemi
Na Zemi pochází asi 90% metanu z produkce živých organismů, menší část je způsobena geologickými aktivitami (např. tavením magmatu). Ve vesmíru však bez dalších podkladů nelze původ metanu prokázat.[1] Zprávy některých médií, které z objevu metanu usuzují na existenci života ve vesmíru, jsou proto považovány za nepodložené.[2]
Použití
Hlavní oblastí použití methanu je energetika, kde slouží ve směsi s jinými uhlovodíky jako plynné palivo. Experimentálně byl kapalný methan použit ve směsi s kapalným kyslíkem jako pohonná látka v raketových motorech. V chemickém průmyslu se používá především k výrobě oxidu uhličitého spalováním se vzduchem a při neúplném spalování k výrobě sazí, používaných jako plnidlo a barvivo v gumárenském průmyslu.
Ekologické účinky
Vzhledem k tomu, že silně absorbuje infračervené záření, patří mezi významné skleníkové plyny zvyšující teplotu zemské atmosféry (je přibližně 20× účinnější než oxid uhličitý),jeho obsah v atmosféře je asi devětkrát menší než u oxidu uhličitého (0,004% methanu a 0,037% oxidu uhličitého).[pozn. 1]
Poznámky
- ↑ Pro přehled účinnosti skleníkových plynů viz tabulka v hesle Skleníkové plyny
Reference
- ↑ BRANDEJSKÁ, Anna. Vědci znovu objevili metan na Marsu, mohl by znamenat život [online]. iDnes, 2009-01-15, [cit. 2009-01-18]. Dostupné online.
- ↑ KUBALA, Petr. Metan na Marsu není téma pro bulvár [online]. Česká astronomická společnost, 200-01-16, [cit. 2009-01-18]. Dostupné online.
Literatura
- Ibler Z. a kol.: Energetika technický průvodce, 2002 BEN - technická literatura, ISBN 80-7300-026-1
Související články
- Bioplyn
- Anaerobní digesce - proces produkce bioplynu
Externí odkazy
- Methane, CH4, Physical properties, safety
- Umweltlexikon
- Metanová časovaná bomba (o ekologických účincích metanu)
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |