a opravdu velká série soutěží o nejlepší webovou stránku !!
Proto neváhejte a začněte hned zítra soutěžit o lákavé ceny !!
Kritický bod
Z Multimediaexpo.cz
m (1 revizi) |
m (Nahrazení textu „</math>“ textem „\)</big>“) |
||
| (Není zobrazena jedna mezilehlá verze.) | |||
| Řádka 1: | Řádka 1: | ||
[[Soubor:fazovy_diagram_priklad.png|thumb|Příklad kritického bodu na fázovém diagramu ''p-T''.]] | [[Soubor:fazovy_diagram_priklad.png|thumb|Příklad kritického bodu na fázovém diagramu ''p-T''.]] | ||
| - | '''Kritický bod''' je [[bod]] na [[fázový diagram|fázovém diagramu]], který zakončuje [[křivka vypařování|křivku vypařování]] (bod ''K'' na [[:soubor:fazovy_diagram_priklad.png|obrázku]]). Tento bod určuje ''kritický stav [[látka|látky]]''. [[stavová veličina|Stavové veličiny]] < | + | '''Kritický bod''' je [[bod]] na [[fázový diagram|fázovém diagramu]], který zakončuje [[křivka vypařování|křivku vypařování]] (bod ''K'' na [[:soubor:fazovy_diagram_priklad.png|obrázku]]). Tento bod určuje ''kritický stav [[látka|látky]]''. [[stavová veličina|Stavové veličiny]] <big>\(p_k\)</big>, <big>\(T_k\)</big> a <big>\(V_k\)</big> v tomto bodě se nazývají '''kritický [[tlak]]''', '''[[kritická teplota]]''' a '''kritický [[objem]]'''. |
<br style="clear:both;" /> | <br style="clear:both;" /> | ||
== Vlastnosti == | == Vlastnosti == | ||
| - | V kritickém stavu mizí rozdíl mezi [[kapalina|kapalinou]] a její [[pára|párou]]. Při teplotě vyšší než kritická teplota < | + | V kritickém stavu mizí rozdíl mezi [[kapalina|kapalinou]] a její [[pára|párou]]. Při teplotě vyšší než kritická teplota <big>\(T_k\)</big> nemůže látka existovat v kapalném [[skupenství]]. Plyn, který má teplotu vyšší než je kritická teplota, nelze žádným [[fyzikální komprese|stlačováním]] [[kapalnění|zkapalnit]]. |
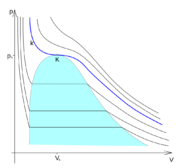
[[Soubor:fazovy_diagram_kriticky_stav.png|thumb|Oblast sycení a kritický stav.]] | [[Soubor:fazovy_diagram_kriticky_stav.png|thumb|Oblast sycení a kritický stav.]] | ||
| - | Zobrazením [[izoterma|izoterm]] v ''p-V'' [[fázový diagram|diagramu]] (viz [[:soubor:fazovy_diagram_kriticky_stav.png|obrázek]]) je vidět, že v ''oblasti sycení'' (označeno barevně) dochází k [[vypařování]] kapaliny (popř. [[kapalnění]] [[plyn|par]]). Nad kritickým bodem < | + | Zobrazením [[izoterma|izoterm]] v ''p-V'' [[fázový diagram|diagramu]] (viz [[:soubor:fazovy_diagram_kriticky_stav.png|obrázek]]) je vidět, že v ''oblasti sycení'' (označeno barevně) dochází k [[vypařování]] kapaliny (popř. [[kapalnění]] [[plyn|par]]). Nad kritickým bodem <big>\(K\)</big> však již oblast sycení neexistuje a k [[fázový přechod|fázové změně]] tam tedy nemůže dojít. Izoterma <big>\(k\)</big>, která prochází kritickým bodem <big>\(K\)</big>, je ''kritickou izotermou''. Při vyšších teplotách , tzv. ''nadkritických'', již izotermy neprochází oblastí sycení a nelze provést [[kapalnění|zkapalnění]] a látka existuje pouze v [[plyn|plynné fázi]]. |
== Související články == | == Související články == | ||
Aktuální verze z 14. 8. 2022, 14:52
Kritický bod je bod na fázovém diagramu, který zakončuje křivku vypařování (bod K na obrázku). Tento bod určuje kritický stav látky. Stavové veličiny \(p_k\), \(T_k\) a \(V_k\) v tomto bodě se nazývají kritický tlak, kritická teplota a kritický objem.
Vlastnosti
V kritickém stavu mizí rozdíl mezi kapalinou a její párou. Při teplotě vyšší než kritická teplota \(T_k\) nemůže látka existovat v kapalném skupenství. Plyn, který má teplotu vyšší než je kritická teplota, nelze žádným stlačováním zkapalnit.
Zobrazením izoterm v p-V diagramu (viz obrázek) je vidět, že v oblasti sycení (označeno barevně) dochází k vypařování kapaliny (popř. kapalnění par). Nad kritickým bodem \(K\) však již oblast sycení neexistuje a k fázové změně tam tedy nemůže dojít. Izoterma \(k\), která prochází kritickým bodem \(K\), je kritickou izotermou. Při vyšších teplotách , tzv. nadkritických, již izotermy neprochází oblastí sycení a nelze provést zkapalnění a látka existuje pouze v plynné fázi.
Související články
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |