The final launch of the Allmultimedia.org will take place on February 27, 2026
(shortly after the 2026 Winter Olympics).
Izotermický děj
Z Multimediaexpo.cz
Izotermický děj je termodynamický děj, při kterém se nemění teplota \(T\) termodynamické soustavy. Při izotermickém ději je tedy \(T=\mbox{konst}\), tedy \(\mathrm{d}T=0\).
Obsah |
Ideální plyn
Pro izotermický děj lze ze stavové rovnice odvodit Boylův-Mariottův zákon:
- \(p V = \mbox{konst}\),
kde \(p\) je tlak plynu a \(V\) je jeho objem. Při izotermickém ději je tedy součin tlaku plynu \(p\) a jeho objemu \(V\) konstantní.
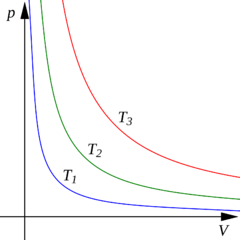
Izoterma
Závislost tlaku na objemu při izotermickém ději je v p-V diagramu vyjádřena křivkou označovanou jako izoterma, která má tvar rovnoosé hyperboly.
Vlastnosti
Poněvadž se při izotermickém ději nemění teplota, nemění se ani vnitřní energie soustavy. Podle první věty termodynamické pak musí platit
- \(\delta Q=p\mathrm{d}V\)
Při izotermickém rozpínání (expanzi) , tzn. \(\mathrm{d}V>0\), je práce vykonaná plynem (tzn. \(p\mathrm{d}V>0\)) plně uhrazena dodaným teplem (\(\delta Q>0\)), neboť v opačném případě by se plyn ochlazoval, což by bylo v rozporu s předpokladem o konstantní teplotě izotermického děje. Při izotermickém stlačování (kompresi) je práce plynu odváděna z plynu ve formě tepla, jinak by se plyn ohříval. Celková vykonaná (spotřebovaná) práce se tedy rovna dodanému (odebranému) teplu, tzn.
- \(\delta Q = \delta A\)
Dosazením stavové rovnice ideálního plynu lze po integraci pro práci získat vztah
- \(A = \int_{V_1}^{V_2}p\mathrm{d}V = nRT \int_{V_1}^{V_2}\frac{\mathrm{d}V}{V} = nRT \ln{\frac{V_2}{V_1}}\),
kde \(V_1, V_2\) označuje počáteční a konečný objem plynu, \(n\) je látkové množství, \(T\) je termodynamická teplota plynu a \(R\) je molární plynová konstanta.
Pomocí Boyle-Mariottova zákona je možné tento vztah přepsat do tvaru
- \(A = Q = nRT \ln{\frac{V_2}{V_1}} = nRT\ln{\frac{p_1}{p_2}}\),
kde \(p_1, p_2\) je počáteční a konečný tlak plynu.
Podle první věty termodynamiky vyplývá z rovnosti práce a tepla, tzn. \(\delta Q=\delta A\), že při izotermickém ději nedochází ke změně vnitřní energie soustavy \(U\), tedy
- \(\mathrm{d}U=0\)
Pro změnu entropie při izotermickém ději lze získat vztah
- \(\Delta S = \int_1^2 \frac{\delta Q}{T} = nR\int_{V_1}^{V_2} \frac{\mathrm{d}V}{V} = nR\ln{\frac{V_2}{V_1}} = nR\ln{\frac{p_1}{p_2}}\)
Důležitou podmínkou izotermického děje je dokonalá výměna tepla. Takovouto dokonalou výměnu tepla však v praxi nelze zajistit, podobně jako nelze zajistit dokonalou tepelnou izolaci systému v případě adiabatických dějů. Reálné děje nejsou tedy ani přesně izotermické, ani přesně adiabatické, ale probíhají někde mezi těmito hraničními případy. Takové děje se nazývají polytropické.
Související články
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |