Foreground plně podporuje – RWD, HTML 5.0, Super Galerii a YouTube 2.0 !
Vnitřní energie
Z Multimediaexpo.cz
Vnitřní energie tělesa je energie všech částic, z nichž se těleso skládá. Jde především o kinetickou a potenciální energii, ale může jít také o elektrickou či chemickou energii, apod. Kinetickou a potenciální energii, kterou má těleso (soustava) jako celek, se do vnitřní energie nezahrnuje.
Vnitřní energie ovlivňuje vlastnosti a stav látky. Např. kinetická energie částic se na tělese projevuje jako teplota tělesa, tzn. čím rychlejší pohyb částic, tím vyšší je teplota tělesa. Polohová energie částic se na tělese projevuje jako pevnost tělesa, tedy čím větší polohová energie částic, tím pevnější je těleso.
Obsah |
Značení
- Symbol veličiny: U
- Odvozená jednotka: joule, značka jednotky: J; Rozměr: [m2.kg.s-2]
- Další jednotky: viz energie
Výpočet
Tepelnému pohybu částic přísluší určitá kinetická energie. Pokud látka obsahuje \(n\) částic o stejné hmotnosti \(m\) a velikost rychlosti \(i\)-té částice je \(v_i\), pak celková kinetická energie takovéto soustavy pak bude
- \(E_k = \sum_{i=1}^n\frac{1}{2}mv_i^2 = \frac{1}{2}m\sum_{i=1}^n v_i^2\)
Je třeba si uvědomit, že těleso jako celek zůstává v klidu. Rychlosti \(\mathbf{v}_i\) jednotlivých částic odpovídají jejich mikroskopickému pohybu. Pokud by se těleso pohybovalo, např. rychlostí \(\mathbf{v}_M\), pak pro určení vnitřní energie \(i\)-té částice se uvažuje s rychlostí \(\mathbf{v}_i-\mathbf{v}_M\).
Kdyby měly všechny částice stejnou rychlost \(v_k\), byla by celková energie soustavy
- \(E_k = \frac{1}{2}nmv_k^2\)
Má-li být celková energie v obou případech stejná, pak musí z předchozích vztahů platit
- \(v_k^2 = \frac{1}{n}\sum_{i=1}^n v_i^2\)
Rychlost \(v_k\) se nazývá střední kvadratickou rychlostí. Kinetická energie určená pomocí střední kvadratické rychlosti se nazývá střední kinetická energie.
Vzájemná soudržnost částic, kterou lze pozorovat u pevných látek a kapalin, vede k závěru, že mezi molekulami musí působit určité síly. Tyto síly se projevují tím, že při vzdálenostech menších než je rozměr atomu se projevují jako odpudivé, a při vzdálenostech větších jako přitažlivé. Tyto síly se nazývají molekulárními (popř. kohezními) silami. Původ těchto sil lze částečně vysvětlit elektrostatickým přitahováním a odpuzováním molekul, avšak plný výklad podává až kvantová fyzika.
Kohezní síly způsobují, že dvě blízké molekuly mají určitou potenciální energii. Odpudivým silám přísluší kladná potenciální energie \(E_1\) a přitažlivým silám přísluší záporná potenciální energie \(E_2\), přičemž hladinu nulové potenciální energie klademe do nekonečna. Celková potenciální energie je pak součtem těchto složek \(E_p=E_1+E_2\).
Celková vnitřní energie soustavy se určí jako sumu kinetických a potenciálních energií jednotlivých částic, tzn.
- \(U = E_k + E_p\)
Vlastnosti
Vnitřní energie určuje tepelný stav a skupenství látky.
Vnitřní energii lze měnit prostřednictvím
- konáním práce - Při konání práce dochází působením vnějších sil ke změně objemu nebo tlaku soustavy, což vede ke změně kinetické energie částic a tedy i celkové vnitřní energie soustavy.
- tepelnou výměnou - Změnou teploty dochází ke změně kinetické energie částic, což má za následek změnu celkové vnitřní energie soustavy.
Vnitřní energie idálního plynu
U ideálního plynu je vnitřní energie dána součtem kinetických energií jednotlivých částic plynu.
Střední kinetická energie molekulového pohybu, tzn. střední hodnota kinetické energie plynu připadající na jednu částici, je
- \(u = \frac{\sum_{i=1}^n \frac{1}{2}mv_i^2}{n} = \frac{1}{2}m\frac{\sum_{i=1}^nv_i^2}{n} = \frac{1}{2}mv_k^2\),
kde \(m\) je hmotnost libovolné částice plynu, \(v_i\) je rychlost \(i\)-té částice, \(n\) je celkový počet částic a \(v_k\) je střední kvadratická rychlost. Dosazením za střední kvadratickou rychlost dostaneme
- \(u = \frac{1}{2}mv_k^2 = \frac{1}{2}m{\left(\sqrt{\frac{3kT}{m}}\right)}^2 = \frac{3}{2}kT\),
kde \(k\) je Boltzmannova konstanta a \(T\) je termodynamická teplota.
Střední kinetická energie částice je tedy přímo úměrná termodynamické teplotě plynu.
Celková vnitřní energie N částic neboli \(n = \frac{N}{N_A}\) molů je podle tohoto vztahu rovna:
- \(U = Nu = \frac{3}{2}NkT = \frac{3}{2}nRT\)
kde \(N_A\) je Avogadrova konstanta, \(k\) je Boltzmannova konstanta a \(R = N_{A}k \) je molární plynová konstanta.
Z výsledků experimentů vyplývá, že vztahy pro vnitřní energii odpovídají jednoatomovým plynům, nevyhovují však dostatečně pro víceatomové plyny. U těchto plynů totiž k vnitřní energii přispívá také rotační pohyb částic. Celková kinetická energie je pak součtem kinetické energie posuvného a rotačního pohybu.
Symetrie částice jednoatomového plynu neumožňuje zahrnout rotaci, neboť při pootočení částice nedojde k žádné změně systému. Takovouto částici lze považovat za hmotný bod. Částice jednoatomového plynu se tedy může pohybovat pouze posuvným pohybem podél tří prostorových os, tzn. má tři stupně volnosti.
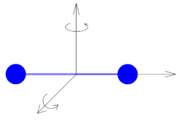
Dvouatomovou molekulu se lze představit jako dva pevně spojené hmotné body. Taková částice může kromě posuvného pohybu konat také pohyb rotační kolem dvou vzájemně kolmých os, které jsou kolmé k ose rotace částice. Kromě tří stupňů volnosti připadajících na posuvný pohyb má tedy tato částice další dva stupně volnosti, které připadají na rotační pohyb, tzn. celkem pět stupňů volnosti.
Podobně u tříatomových a víceatomových molekul připadají na posuvný pohyb tři stupně volnosti a na rotační pohyb další tři stupně volnosti, neboť tato částice může rotovat kolem všech prostorových os. Celkem je to tedy šest stupňů volnosti.
| Plyn | Počet stupňů volnosti |
| jednoatomový | 3 |
| dvouatomový | 5 |
| tříatomový a víceatomový | 6 |
Ekvipartiční teorém
Pokud na tři stupně volnosti částice jednoatomového plynu připadá energie \(u = \frac{3}{2}kT\), pak lze předpokládat, že na jeden stupeň volnosti připadá energie
- \(u_1 = \frac{1}{2}kT\)
Tento závěr je důsledkem předpokladu o rovnoměrném rozdělení energie, který je znám jako ekvipartiční teorém. Ekvipartiční teorém lze formulovat následovně:
- Energie soustavy je rovnoměrně rozdělena na všechny platné stupně volnosti.
Pro \(i\) stupňů volnosti je možné tuto skutečnost zapsat v matematické formě
- \(u_i = \frac{i}{2}kT\)
Ekvipartiční teorém lze využít např. pro určení molární tepelné kapacity \(C_V\), kterou lze získat prostřednictvím vztahu
- \(C_V = U_{T+1}-U_T = \frac{i}{2}R(T+1)-\frac{i}{2}RT = \frac{i}{2}R\)
Pro jednotlivé typy plynů platí následující vztahy.
| Plyn | vnitřní energie na jednu částici | celková vnitřní energie | molární tepelná kapacita |
| jednoatomový | \(\frac{3}{2}kT\) | \(\frac{3}{2}RT\) | \(\frac{3}{2}R\) |
| dvouatomový | \(\frac{5}{2}kT\) | \(\frac{5}{2}RT\) | \(\frac{5}{2}R\) |
| tříatomový a víceatomový | \(3kT\) | \(3RT\) | \(3R\) |
Související články
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |