a opravdu velká série soutěží o nejlepší webovou stránku !!
Proto neváhejte a začněte hned zítra soutěžit o lákavé ceny !!
Elektronový obal
Z Multimediaexpo.cz
m (Nahrazení textu) |
m (Nahrazení textu „</math>“ textem „\)</big>“) |
||
| (Nejsou zobrazeny 2 mezilehlé verze.) | |||
| Řádka 6: | Řádka 6: | ||
[[Hmotnost]] elektronového obalu tvoří okolo 0,01 % celkové hmotnosti atomu. | [[Hmotnost]] elektronového obalu tvoří okolo 0,01 % celkové hmotnosti atomu. | ||
== Vlastnosti elektronů v obalu == | == Vlastnosti elektronů v obalu == | ||
| - | Vlastnosti elektronů v elektronovém obalu jsou dány řešením [[Schrödingerova rovnice|Schrödingerovy rovnice]] pro daný atom. Z řešení pro [[vodík]]ový atom vyplývá, že vlastnosti elektronů v obalu lze charakterizovat prostřednictvím čtyř [[kvantové číslo|kvantových čísel]]: [[hlavní kvantové číslo|hlavního kvantového čísla]], [[orbitální kvantové číslo|orbitálního]], [[magnetické kvantové číslo|magnetického]] a [[spinové kvantové číslo|spinového kv. čísla]]. [[Energie]] elektronu je závislá na hlavním kvantovém čísle < | + | Vlastnosti elektronů v elektronovém obalu jsou dány řešením [[Schrödingerova rovnice|Schrödingerovy rovnice]] pro daný atom. Z řešení pro [[vodík]]ový atom vyplývá, že vlastnosti elektronů v obalu lze charakterizovat prostřednictvím čtyř [[kvantové číslo|kvantových čísel]]: [[hlavní kvantové číslo|hlavního kvantového čísla]], [[orbitální kvantové číslo|orbitálního]], [[magnetické kvantové číslo|magnetického]] a [[spinové kvantové číslo|spinového kv. čísla]]. [[Energie]] elektronu je závislá na hlavním kvantovém čísle <big>\(n\)</big>, velikost [[moment hybnosti|momentu hybnosti]] závisí na orbitálním kvantovém čísle <big>\(l\)</big> a směr momentu hybnosti je určen magnetickým kvantovým číslem <big>\(m_l\)</big>. Ve složitějších atomech závislosti již nejsou tak jednoduché, např. energetické hladiny závisí nejen na hlavním kvantovém čísle <big>\(n\)</big>, ale také na [[vedlejší kvantové číslo|vedlejším kvantovém čísle]] <big>\(l\)</big> apod. |
V elektronových obalech složitějších atomů se nachází více elektronů. V takovém případě je nutné brát v úvahu také tzv. [[spin]] elektronu. | V elektronových obalech složitějších atomů se nachází více elektronů. V takovém případě je nutné brát v úvahu také tzv. [[spin]] elektronu. | ||
Elektrony se v elektronovém obalu umisťují do [[Atomový orbital|orbitalů]]. | Elektrony se v elektronovém obalu umisťují do [[Atomový orbital|orbitalů]]. | ||
Aktuální verze z 14. 8. 2022, 14:51
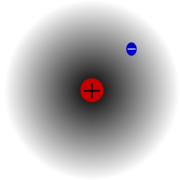
Elektronový obal je systém elektronů vázaných k jádru atomu. Elektronový obal obklopuje atomové jádro a zaujímá většinu prostoru atomu.
Vlastnosti elektronového obalu
Elektronový obal je tvořen pouze elektrony a proto má záporný elektrický náboj, který je v atomu neutralizovaný kladným nábojem jádra atomu. Proto je atom jako celek elektricky neutrální. Neutrální atomy obsahují v elektronovém obalu stejný počet elektronů, jaký je v jádře počet protonů. U kladně nabitých iontů je počet elektronů v elektronovém obalu menší, u záporně nabitých iontů je počet elektronů v obalu větší. Poloměr elektronového obalu (a tedy celého atomu) se pohybuje kolem 10-10 m. Hmotnost elektronového obalu tvoří okolo 0,01 % celkové hmotnosti atomu.
Vlastnosti elektronů v obalu
Vlastnosti elektronů v elektronovém obalu jsou dány řešením Schrödingerovy rovnice pro daný atom. Z řešení pro vodíkový atom vyplývá, že vlastnosti elektronů v obalu lze charakterizovat prostřednictvím čtyř kvantových čísel: hlavního kvantového čísla, orbitálního, magnetického a spinového kv. čísla. Energie elektronu je závislá na hlavním kvantovém čísle \(n\), velikost momentu hybnosti závisí na orbitálním kvantovém čísle \(l\) a směr momentu hybnosti je určen magnetickým kvantovým číslem \(m_l\). Ve složitějších atomech závislosti již nejsou tak jednoduché, např. energetické hladiny závisí nejen na hlavním kvantovém čísle \(n\), ale také na vedlejším kvantovém čísle \(l\) apod. V elektronových obalech složitějších atomů se nachází více elektronů. V takovém případě je nutné brát v úvahu také tzv. spin elektronu. Elektrony se v elektronovém obalu umisťují do orbitalů. Elektrony nacházející se ve vnější slupce elektronového obalu se označují jako valenční. Valenční elektrony jsou významné pro chemické vazby a jsou odpovědné za chemické vlastnosti atomu (nebo molekuly).
Související články
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |