Foreground plně podporuje – RWD, HTML 5.0, Super Galerii a YouTube 2.0 !
Elektronová konfigurace
Z Multimediaexpo.cz
Elektronová konfigurace popisuje uspořádání elektronů uvnitř elektronového obalu. Předpokládá se, že se elektrony převážně vyskytují v prostoru, který se nazývá atomový nebo molekulový orbital.
Obsah |
Elektronová konfigurace v atomu
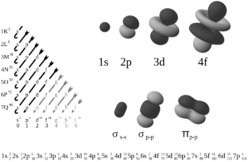
Stav elektronu v atomu je popsán pomocí čtyř kvantových čísel. První tři čísla jsou celočíselná a popisují vlastnosti příslušného atomového orbitalu.
| Kvantové číslo | Značka | Rozsah | Popis |
|---|---|---|---|
| Hlavní kvantové číslo | n | jen přirozená čísla, 1 a více | určuje energii orbitalu, také popisuje vzdálenost orbitalu od atomového jádra |
| Vedlejší kvantové číslo | l | celočíselné, 0 až n−1 | orbitální moment hybnosti elektronu, čímž určuje tvar atomového orbitalu |
| Magnetické kvantové číslo | m | celočíselné, −l až +l | magnetický moment hybnosti elektronu, také popisuje prostorovou orientaci atomového orbitalu |
| Spinové kvantové číslo | s | +½ nebo −½ | Spin je vnitřní vlastností elektronu a je nezávislý na předchozích kvantových číslech, určuje "rotaci" elektronu |
V atomu nejsou přítomny dva elektrony, které by měly všechna čtyři kvantová čísla stejná (Pauliho vylučovací princip).
Slupky a podslupky
Elektronové slupky a podslupky (někdy také nazývané energetické hladiny a podhladiny) jsou definovány kvantovými čísly, a nikoliv vzdáleností od jádra. U velkých atomů se slupky mohou překrývat.
Elektrony se stejným n leží ve stejné elektronové slupce.
Elektrony se stejným n i l leží ve stejné elektronové podslupce.
Elektrony, které mají stejné n, l i m leží ve stejném orbitalu.
Protože existují pouze dvě hodnoty spinu, mohou být v každém orbitalu pouze dva elektrony. Podslupka tedy může obsahovat maximálně \(4 l+2\) elektrony a slupka maximálně \(2n^2\) elektronů.
Příklad
| Slupka | Podslupka | Orbital | Počet elektronů | |
| n = 5 | l = 0 | m = 0 | → 1 typ s orbitalu | → max 2 elektrony |
| l = 1 | m = -1, 0, +1 | → 3 typy p orbitalu | → max 6 elektronů | |
| l = 2 | m = -2, -1, 0, +1, +2 | → 5 typů d orbitalu | → max 10 elektronů | |
| l = 3 | m = -3, -2, -1, 0, +1, +2, +3 | → 7 typů f orbitalu | → max 14 elektronů | |
| l = 4 | m = -4, -3 -2, -1, 0, +1, +2, +3, +4 | → 9 typů g orbitalu | → max 18 elektronů | |
| Celkem: max 50 elektronů |
Tuto tabulku lze jednoduše zapsat takto: 5s2 5p6 5d10 5f14 5g18.
Označení podslupek s, p, d, f má původ v označení odpovídajících čar ve spektrech „sharp“ (ostrá), „principal“ (hlavní), „diffuse“ (difuzní), „fundamental“ (základní). Další orbitaly se již označují po sobě jdoucími písmeny abecedy (g, h, …).
Notace
Ve fyzice a chemii se nejčastěji používá notace ve stylu nxe, kde n je číslo slupky, x je číslo podslupky a e je počet elektronů v podslupce. Jednotlivé orbitaly se zapisují v pořadí vzrůstající energie. Např. základní stav atomu fosforu zapíšeme takto: 1s2 2s2 2p6 3s2 3p3.
Zápis konfigurace atomu s velkým počtem elektronů by byl velmi dlouhý, proto existuje i zkrácená notace, kdy na začátku zápisu uvedeme nejbližší vzácný plyn a poté zapíšeme elektrony, které má prvek navíc. Zápis elektronové konfigurace fosforu bude vypadat takto: [Ne] 3s2 3p3.
Výstavbový princip
Výstavbový princip (tzv. Aufbau princip) říká, že orbitaly s nižší energií se zaplňují elektrony dříve než orbitaly s energií vyšší.
V základním stavu atomu tedy elektrony obsazují jednotlivé slupky a podslupky tak, aby měly co nejnižší energii.
Elektronový pár se stejnou orientací spinů obou elektronů má mírně menší energii, než elektronový pár s opačnou orientací spinů. Protože v jednom orbitalu mohou být pouze elektrony s opačným spinem, dochází nejprve k obsazení identických orbitalů (se stejným n a l) jedním elektronem a poté teprve dochází k párování elektronů.
Pro obsazování orbitalů elektrony je tedy rozhodující součet hlavního kvantového čísla n a vedlejšího kvantového čísla l a pak teprve velikost hlavního kvantového čísla n, tzn.
- přednostně se obsadí orbital, u něhož je součet \(n+l\) menší
- z orbitalů se stejným součtem \(n+l\), se jako první zaplní ten, jehož hlavní kvantové číslo n je menší
Orbitaly se tady zaplňují v následujícícm pořadí: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, …
Výjimky
Energie d orbitalu, který je zcela nebo z poloviny zaplněný, je nižší než energie nejbližšího s orbitalu. Proto v případě d4 a d9 prvků dochází k přeskoku jednoho elektronu z s orbitalu do orbitalu d. Např. elektronová konfigurace chromu je [Ar] 4s1 3d5, nikoliv [Ar] 4s2 3d4.
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |