Protilátka
Z Multimediaexpo.cz
Protilátka (imunoglobulin) je protein, který je schopen jako součást imunitního systému identifikovat a zneškodnit cizí objekty (bakterie a viry) v těle. Protilátky jsou nositeli humorální imunity.
Obsah |
Chemická struktura
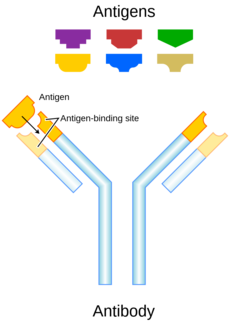
Funkci protilátek v těle plní glykoproteiny, označované jako imunoglobuliny. Během imunitní odpovědi jsou syntetizovány a vylučovány plazmatickými buňkami, tzn. diferencovanými B-lymfocyty. Molekula imunoglobulinu má tvar Y, a skládá se ze dvou identických lehkých (L, light) řetězců, a dvou těžkých (H, heavy) řetězců, které jsou navzájem spojeny pomocí disulfidových můstků. Každý řetězec můžeme pomyslně rozdělit na funkční oblasti, domény. Část řetězců směrem k amino-konci se nazývá variabilní oblast, naopak úsek řetězce směrem ke karboxylovému konci je oblast konstantní. Variabilní oblasti jsou heterogenní, u různých dvou lidí nebyly nikdy nalezeny dvě variabilní oblasti se stejnou sekvencí aminokyselin. Některé úseky variabilních oblastí jsou dokonce hypervariabilní, naprosto jedinečné pro daného jedince. To tvoří jedinečnou strukturu „ramének“ imunoglobulinu, do které pak jako klíč do zámku zapadá antigen, pro který je protilátka specifická. Proto každá protilátka rozpoznává jen „ten svůj“ antigen. „Nožička“ imunoglobulinu je tvořena těžkými řetězci, tvoří krystalizující fragment, tzv. Fc fragment. Tyto Fc fragmenty imunoglobulínů se váží na Fc receptory na leukocytech. „Raménka“ jsou pak tvořena lehkým řetězcem a těžkým řetězcem, který přechází z krystalizujícího fragmentu. Tyto části imunoglobulinu se nazývají antigen vázající fragmenty (Fab - z angl. antigen binding fragment). Přechod ramének v nožičku se nazývá závěs (hinge), v tomto místě je molekula velmi pohyblivá, raménka se mohou otevírat nebo zavírat podle velikosti antigenu, na který se váží. V místě závěsu také na molekulu působí enzymy, jako je papain nebo pepsin, které ji štěpí.
Lehký řetězec
Známe dva typy lehkých řetězců, kappa (κ) a lambda (λ). Oba sestávají z cca 211 až 217 aminokyselin (Mr=23 000). Jsou si velmi podobné, přesto se v jedné molekule nikdy nevyskytují oba typy, imunoglobulin vždy obsahuje buď dva řetězce κ nebo dva řetězce λ. Variabilní oblast tvoří asi polovinu řetězce, druhá polovina je konstantní.
Těžký řetězec
Existuje pět typů těžkých řetězců, které se liší strukturou konstantní oblasti. Jsou označovány jako α, γ, δ, ε a μ. Těžké řetězce α a γ se skládají z přibližně 450 aminokyselin, μ a ε tvoří asi 550 aminokyselin. Variabilní oblasti tvoří asi 1/4 amino-konce těžkého řetězce.
Třídy imunoglobulinů
Podle typu těžkého řetězce, který tvoří imunoglobulin, je rozdělujeme na pět tříd, izotypů: IgA, IgG, IgD, IgE, a IgM. Typ těžkého řetězce, zvláště struktura krystalizujícího fragmentu, kterým se imunoglobuliny váží na buněčné receptory, ovlivňuje jejich interakci s bílými krvinkami i proteiny, jako je systém komplementu. Protilátky, které produkuje jedna plazmatická buňka, se mohou lišit typy těžkého řetězce, buňka může produkovat více tříd imunoglobulinů naráz, ale všechny imunoglobuliny produkované jednou plazmatickou buňkou jsou specifické pro určitý antigen, mají stejnou variabilní oblast. Aby se organismus dokázal ubránit proti velkému množství možných antigenů, musí tvořit milióny B-lymfocytů. Je důležité si uvědomit, že pokud by všechny možné variabilní oblasti specifické pro všechny možné antigeny byly kódovány geny, imunitní systém by potřeboval pro svou funkci více genů, než obsahuje celý lidský genom. Místo toho, jak dokázal Susumu Tonegawa v roce 1976, B-lymfocyt dokáže rekombinovat části genomu a vytvořit tak všechny variace struktur protilátek. Tonegawa za svůj objev v roce 1987 získal Nobelovu cenu za fyziologii a lékařství.
IgG
- Podrobnější informace naleznete na stránce: imunoglobulin G
IgG je nejčastěji se vyskytující imunoglobulin, je přítomen v krvi i v tkáňovém moku. Vyskytuje se jako monomer. Je to jediný izotyp, který může přecházet přes placentu a chrání tak plod před choroboplodnými zárodky ještě než se vytvoří jeho vlastní imunitní systém. Váže se na viry, bakterie i houby a společně s komplementem je dokáže zničit. Existují čtyři podtřídy IgG: IgG1 (66%), IgG2 (23%), IgG3 (7%) a IgG4 (4%). IgG1, IgG3 a IgG4 snadno přecházejí přes placentární bariéru. IgG3 je nejefektivnější aktivátor komplementu, následuje IgG1 a IgG2. IgG1 a IgG3 se také vážou na Fc receptory fagocytujících buněk, označují jim patogeny a tím zajišťují, že budou fagocyty zničeny.
IgA
- Podrobnější informace naleznete na stránce: imunoglobulin A
IgA tvoří asi 15 % až 20 % sérových imunoglobulinů. Proniká do trávicího traktu, nachází se v mléku, slzách a slinách. Je to protilátka, která pomáhá bojovat proti patogenům, které se dostaly na vnější nebo i vnitřní povrch těla. Nemá schopnost aktivovat systém komplementu. Existují dvě podtřídy, IgA1 (90%) a IgA2 (10%). Molekula IgA2 není v závěsu spojena disulfidovými vazbami, ale nekovalentně. Tvoří většinu tzv. sekrečního IgA, protilátky v tělních sekretech. Slizniční IgA je dimer, dva monomery spojené polypeptidovým J řetězcem, bohatým na cystein a sekreční složkou, polypeptidem, který je syntetizován epiteliemi.
IgM
- Podrobnější informace naleznete na stránce: imunoglobulin M
IgM tvoří polymery, zpravidla se vyskytuje jako pentamer, někdy i jako hexamer. Jsou to velké (900 kD), těžko rozpustné molekuly. Pentamery obsahují J řetězec. Každý monomer může vázat dva antigeny, pentamer IgM by tedy měl mít schopnost vázat 10 antigenů najednou, to ale neplatí, protože jednotlivá vazebná místa pro antigeny se navzájem prostorově omezují. IgM se vyskytuje hlavně v séru, tedy v krvi, někdy i v tělních sekretech. Je to velmi dobrý aktivátor komplementu.
IgD
- Podrobnější informace naleznete na stránce: imunoglobulin D
IgD tvoří asi 1 % membránových proteinů mladých B-lymfocytů, v malém množství se vyskytuje v séru. Jeho funkce je neznámá, myši bez IgD nemají narušený imunitní systém, což naznačuje nadbytečnost nebo i nefunkčnost. IgD není syntetizován dospělými B-lymfocyty. Možná slouží jako regulační receptor.
IgE
- Podrobnější informace naleznete na stránce: imunoglobulin E
IgE obsahuje ze všech imunoglobulinů největší procentuální zastoupení sacharidů. Je přítomen na membráně basofilních granulocytů a žírných buněk. Hraje roli při hypersenzitivitě a ochraně vůči parazitům. Neaktivuje komplement.
Působení protilátek
- opsonizace („ochucení“) - antigen přitahuje fagocytující buňky
- vazbou znehodnotí účinnost antigenu
- protilátky spojí antigeny do větších nerozpustných celků
Užití v praxi
Užití v diagnostice
Reakce protilátek s antigenem je základem všech sérologických metod využívaných jak v humánní tak veterinární medicíně. Jednotlivé metody se liší způsobem jejich vizualizace, přičemž existuje velké množství detekčních systémů umožňujícíh zviditelnit uskutečněnou reakci antigenu s protilátkou. Využitím totoho principu (antigen-protilátka) lze diagnostikovat široké spektrum infekčních či autoimunitních chorob člověka a zvířat. Principy metod detekující přítomnost protilátek (název metody):
- precipitace - imunodifuze, vstřícná protisměrná imunoelektroforéza
- aglutinace - Coombsův test, pasivní hemaglutinace, inhibice hemaglutinace
- vazba komplementu - komplement fixační reakce
- enzymové reakce - ELISA (z anglického Enzyme-linked Immunosorbent Assay)
- neutralizace viru - Virus neutralizační test
- radiační metody - RIA (z anglického Radioimmunoassay), RAST (z anglického Radioallergosorbent), radioimunoprecipitace
Užití v biochemii, mikrobiologii a histologii
Imunohistochemie a testy jako je ELISA nebo ELISPOT využívají specifity protilátek k určitým strukturám. Používají se značené protilátky, které po osvícení ultrafialovým světlem fluoreskují.
Zkratky označující zdroj protilátek
(mohou se lišit)
- Hu (human) - člověk
- Ms (mouse) - myš
- Mk (monkey) - opice
- Rt (rat)- potkan
- Sw (swine) - prasečí protilátka
- B (bovine) - hovězí (kraví) protilátka
Související články
- Imunitní systém
- Humorální imunita
- monoklonální protilátka (anglická zkratka: mAb)
- imunohistochemie
- sérologie
- ELISA
Literatura
- Pier GB, Lyczak JB, and Wetzler LM. (2004). Immunology, Infection, and Immunity. ASM Press. ISBN 1-55581-246-5
- Rhoades, Rodney and Richard Pflanzer (2002). Human Physiology (4th ed.). Brooks/Cole. ISBN 0-534-42174-1
- Janeway, Travers, Walport and Shlomchik (2005). Immunobiology (6th ed.). Garland Science. ISBN 0-443-07310-4
- MURRAY, Robert K., et al. Harperova biochemie. Z angl. 23. vyd. přel. Lenka Fialová et. al. 4. vyd. v ČR. Praha: H & H, 2002. ix, 872 s. ISBN 80-7319-013-3.
- MURRAY, Robert K., et al. Harperova biochemie. Z angl. 23. vyd. přel. Lenka Fialová et. al. 3. vyd. v ČR. Praha: H & H, 2001. ix, 872 s. ISBN 80-7319-003-6.
- MURRAY, Robert K., et al. Harperova biochemie. Z angl. 23. vyd. přel. Lenka Fialová et. al. 2. vyd. v ČR. Praha: H & H, 1996. ix, 872 s. ISBN 80-85787-38-5.
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |