a opravdu velká série soutěží o nejlepší webovou stránku !!
Proto neváhejte a začněte hned zítra soutěžit o lákavé ceny !!
Oxid uhelnatý
Z Multimediaexpo.cz
m (Nahrazení textu „{{Chybí zdroj}}“ textem „“) |
(++) |
||
| (Není zobrazena jedna mezilehlá verze.) | |||
| Řádka 2: | Řádka 2: | ||
|Název=Oxid uhelnatý | |Název=Oxid uhelnatý | ||
|Obrázek=[[Soubor:Carbon-monoxide-2D-dimensions.png |140px]] | |Obrázek=[[Soubor:Carbon-monoxide-2D-dimensions.png |140px]] | ||
| - | |||
|Systematický název=oxid uhelnatý | |Systematický název=oxid uhelnatý | ||
|Latinský název=Carbonii monoxidum<br />Monoxidum carbonis | |Latinský název=Carbonii monoxidum<br />Monoxidum carbonis | ||
| Řádka 34: | Řádka 33: | ||
|Teplota vzplanutí=−191 °C | |Teplota vzplanutí=−191 °C | ||
|Teplota vznícení= 609 °C | |Teplota vznícení= 609 °C | ||
| - | }} | + | }}[[Soubor:Carbon-monoxide-3D-balls.png|thumb|240px|Schéma molekuly oxidu uhelnatého]] |
'''Oxid uhelnatý''' (starší terminologií ''[[Oxidy|kysličník]] uhelnatý'') je bezbarvý [[plyn]] bez chuti a zápachu, lehčí než [[vzduch]], nedráždivý. Ve vodě je málo rozpustný. Je obsažen ve [[svítiplyn]]u, v [[generátorový plyn|generátorovém]] a ve [[vodní plyn|vodním plynu]]; má silně redukční vlastnosti. V přírodě je přítomen v nepatrném množství v atmosféře, kde vzniká především [[fotolýza|fotolýzou]] [[oxid uhličitý|oxidu uhličitého]] působením [[ultrafialové záření|ultrafialového záření]], jako produkt nedokonalého spalování [[Fosilní palivo|fosilních paliv]] i biomasy. Je také obsažen v sopečných plynech. V mezihvězdném prostoru se vyskytuje ve značném množství. Byl nalezen i v atmosféře [[Mars (planeta)|Marsu]] (0,08 %) a [[spektroskopie|spektroskopicky]] prokázan v komě [[kometa|komet]]. | '''Oxid uhelnatý''' (starší terminologií ''[[Oxidy|kysličník]] uhelnatý'') je bezbarvý [[plyn]] bez chuti a zápachu, lehčí než [[vzduch]], nedráždivý. Ve vodě je málo rozpustný. Je obsažen ve [[svítiplyn]]u, v [[generátorový plyn|generátorovém]] a ve [[vodní plyn|vodním plynu]]; má silně redukční vlastnosti. V přírodě je přítomen v nepatrném množství v atmosféře, kde vzniká především [[fotolýza|fotolýzou]] [[oxid uhličitý|oxidu uhličitého]] působením [[ultrafialové záření|ultrafialového záření]], jako produkt nedokonalého spalování [[Fosilní palivo|fosilních paliv]] i biomasy. Je také obsažen v sopečných plynech. V mezihvězdném prostoru se vyskytuje ve značném množství. Byl nalezen i v atmosféře [[Mars (planeta)|Marsu]] (0,08 %) a [[spektroskopie|spektroskopicky]] prokázan v komě [[kometa|komet]]. | ||
Připravuje se spalováním [[uhlík]]u s malým množstvím [[kyslík]]u: | Připravuje se spalováním [[uhlík]]u s malým množstvím [[kyslík]]u: | ||
| Řádka 48: | Řádka 47: | ||
Oxid uhelnatý se dříve používal jako plynné [[palivo]] (například součást [[svítiplyn]]u). Jeho směs s [[vodík]]em ([[vodní plyn]]) je jedním z meziproduktů používaných v těžkém chemickém průmyslu. | Oxid uhelnatý se dříve používal jako plynné [[palivo]] (například součást [[svítiplyn]]u). Jeho směs s [[vodík]]em ([[vodní plyn]]) je jedním z meziproduktů používaných v těžkém chemickém průmyslu. | ||
== Zdroje oxidu uhelnatého a jeho výskyt v ovzduší == | == Zdroje oxidu uhelnatého a jeho výskyt v ovzduší == | ||
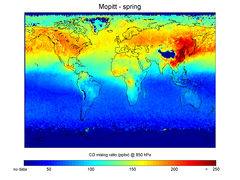
| - | [[Soubor: | + | [[Soubor:Carbon Monoxide concentrations in spring.jpg|thumb|240px|Výskyt oxidu uhelnatého v atmosféře v roce 2004]] |
Vzhledem k jedovatosti je jednou z významných znečišťujících latek. Vzniká při nedokonalém [[spalování]] [[uhlík]]u a [[organická sloučenina|organických látek]], je emitován např. automobily, lokálními topeništi, energetickým a metalurgickým průmyslem. | Vzhledem k jedovatosti je jednou z významných znečišťujících latek. Vzniká při nedokonalém [[spalování]] [[uhlík]]u a [[organická sloučenina|organických látek]], je emitován např. automobily, lokálními topeništi, energetickým a metalurgickým průmyslem. | ||
CO vzniká zejména pokud: | CO vzniká zejména pokud: | ||
| Řádka 71: | Řádka 70: | ||
* [http://www.tlakinfo.cz/t.py?t=2&i=1233 Už víte vše o otravě oxidem uhelnatým? - Informační servis ČSTZ 2/2006] | * [http://www.tlakinfo.cz/t.py?t=2&i=1233 Už víte vše o otravě oxidem uhelnatým? - Informační servis ČSTZ 2/2006] | ||
* [http://www.pozary.cz/rubriky/prevence/oxid-uhelnaty-zabiji_22031.html Oxid uhelnatý zabíjí...] | * [http://www.pozary.cz/rubriky/prevence/oxid-uhelnaty-zabiji_22031.html Oxid uhelnatý zabíjí...] | ||
| - | |||
| - | |||
| + | |||
| + | {{Oxidy II.}}{{Fosilní paliva}}{{Článek z Wikipedie}} | ||
[[Kategorie:Uhelnaté sloučeniny]] | [[Kategorie:Uhelnaté sloučeniny]] | ||
[[Kategorie:Oxidy|Uhelnatý]] | [[Kategorie:Oxidy|Uhelnatý]] | ||
[[Kategorie:Polutanty]] | [[Kategorie:Polutanty]] | ||
| - | |||
Aktuální verze z 25. 6. 2020, 08:14
Oxid uhelnatý (starší terminologií kysličník uhelnatý) je bezbarvý plyn bez chuti a zápachu, lehčí než vzduch, nedráždivý. Ve vodě je málo rozpustný. Je obsažen ve svítiplynu, v generátorovém a ve vodním plynu; má silně redukční vlastnosti. V přírodě je přítomen v nepatrném množství v atmosféře, kde vzniká především fotolýzou oxidu uhličitého působením ultrafialového záření, jako produkt nedokonalého spalování fosilních paliv i biomasy. Je také obsažen v sopečných plynech. V mezihvězdném prostoru se vyskytuje ve značném množství. Byl nalezen i v atmosféře Marsu (0,08 %) a spektroskopicky prokázan v komě komet. Připravuje se spalováním uhlíku s malým množstvím kyslíku:
- 2C + O2 → 2CO,
případně reakcí vodní páry s uhlíkem za vysokých teplot (příprava vodního plynu):
- C + H2O → CO + H2.
V nepatrném množství vzniká i metabolickými procesy v živých organismech a proto je obsažen ve stopových množstvích ve vydechovaném vzduchu z plic. S kyslíkem se prudce slučuje (hoří namodralým plamenem) na oxid uhličitý:
- 2CO + O2 → 2CO2
za uvolnění značného množství tepla. Ve směsi se vzduchem, obsahující od 12,5 do 74,2% oxidu uhelnatého, vybuchuje. Oxid uhelnatý je značně jedovatý; jeho jedovatost je způsobena silnou afinitou k hemoglobinu (krevnímu barvivu), s nímž vytváří karboxyhemoglobin (COHb), čímž znemožňuje přenos kyslíku v podobě oxyhemoglobinu z plic do tkání. Vazba oxidu uhelnatého na hemoglobin je přibližně dvousetkrát silnější než kyslíku a proto jeho odstranění z krve trvá mnoho hodin až dní. Příznaky otravy se objevují již při přeměně 10 % hemoglobinu na karboxyhemoglobin. Toto je podstatou jednoho ze škodlivých vlivů kouření.
Obsah |
Užití
Oxid uhelnatý se dříve používal jako plynné palivo (například součást svítiplynu). Jeho směs s vodíkem (vodní plyn) je jedním z meziproduktů používaných v těžkém chemickém průmyslu.
Zdroje oxidu uhelnatého a jeho výskyt v ovzduší
Vzhledem k jedovatosti je jednou z významných znečišťujících latek. Vzniká při nedokonalém spalování uhlíku a organických látek, je emitován např. automobily, lokálními topeništi, energetickým a metalurgickým průmyslem. CO vzniká zejména pokud:
- je teplota spalování příliš nízká, aby mohlo dojít k úplné oxidaci pohonných látek na oxid uhličitý,
- čas hoření ve spalovací komoře je příliš krátký,
- nebo není k dispozici dostatek kyslíku.
Díky povinnému zavedení řízených katalyzátorů u vozidel s benzínovými motory se emise oxidu uhelnatého v poslední době snižují. V roce 2005 v České republice nepřekračovaly pozaďové koncentrace 300 µg/m3. V Praze činily roční aritmetické průměry v oblastech zatížených dopravou cca tisíc µg/m3.[1] Při používání plynu k vaření v domácnostech je koncentrace CO v domácím ovzduší průměrně cca 2,9 mg/m3[2].
Kouření
Významnou příčinou vystavení oxidu uhelnatému je kouření. Lidé kouřící cca 20 cigaret denně mají v krvi asi 4 až 7 % hemoglobinu zablokováno působením CO.[3] Při pasivním kouření je člověk vystaven v průměru koncentracím okolo 1,7 mg/m3[2].
Otrava oxidem uhelnatým
- Hlavní článek: Otrava oxidem uhelnatým
Oxid uhelnatý blokuje přenášení kyslíku krví neboť jeho vazba s hemoglobinem je 200x až 300x pevnější než vazba kyslíku. U postiženého je typické třešňové zbarvení kůže a sliznic. Otrava CO se vyskytuje např. v uzavřených prostorech, kde běží spalovací motory nebo při špatném odvětrání plynových spotřebičů. První pomoc spočívá v přerušení kontaktu (vyvětrat, vynést z prostoru), dále podání kyslíku a pokud došlo k zástavě oběhu je třeba resuscitovat.
Reference
- ↑ Miroslav Šuta: Účinky výfukových plynů z automobilů na lidské zdraví (druhé, přepracované a doplněné vydání, Děti Země 2008, ISBN 80-86678-10-5
- ↑ 2,0 2,1 Carbon Monoxide - International Programme on Chemical Safety - Environmental Health Criteria 213
- ↑ Miroslav Šuta: Účinky výfukových plynů z automobilů na lidské zdraví (druhé, přepracované a doplněné vydání, Děti Země 2008, ISBN 80-86678-10-5
Související články
Externí odkazy
| Oxidy s prvkem v oxidačním čísle II. |
|---|
|
Oxid hlinečnatý (AlO) • Oxid barnatý (BaO) • Oxid beryllnatý (BeO) • Oxid kademnatý (CdO) • Oxid vápenatý (CaO) • Oxid uhelnatý (CO) • Oxid kobaltnatý (CoO) • Oxid měďnatý (CuO) • Oxid železnatý (FeO) • Oxid olovnatý (PbO) • Oxid hořečnatý (MgO) • Oxid rtuťnatý (HgO) • Oxid nikelnatý (NiO) • Oxid dusnatý (NO) • Oxid palladnatý (PdO) • |
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |