The final launch of the Allmultimedia.org will take place on February 27, 2026
(shortly after the 2026 Winter Olympics).
Rtuť
Z Multimediaexpo.cz
| Rtuť | |
| |
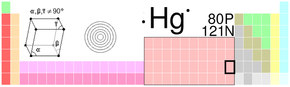
| Atomové číslo | 80 |
| Relativní atomová hmotnost | 200,59(2) amu |
| Elektronová konfigurace | [Xe] 4f14 5d10 6s2 |
| Elektronegativita (Pauling) | 2,00 |
| Teplota tání | −38,83 °C (234,32 K) |
| Teplota varu | 356,73 °C (629,88 K) |
| Hustota | 13,534 g.cm-3 |
| Registrační číslo CAS | 7439-97-6 |
Rtuť, chemická značka Hg, lat. Hydrargyrum je těžký, toxický kovový prvek. Slouží jako součást slitin (amalgámů) a jako náplň různých přístrojů (teploměry, barometry). Je jediným kovem, který je za normálních podmínek kapalný.
Obsah |
Základní fyzikálně - chemické vlastnosti
Rtuť je kapalný kovový prvek stříbřitě bílé barvy. Je nápadně těžká a dobře vede elektrický proud. Patří mezi přechodné prvky, které mají valenční elektrony v d-sféře. Ve sloučeninách se vyskytuje v mocenství Hg+1 (kovalentní vazba rtuť-rtuť) a Hg+2, přičemž vlastnosti sloučenin rtuťných se podobají sloučeninám stříbrným, zatímco rtuťnaté soli připomínají spíše sloučeniny měďnaté. Z minerálních kyselin je rtuť dobře rozpustná v kyselině dusičné za vývoje oxidů dusíku. Na vzduchu je rtuť neomezeně stálá, velmi ochotně však reaguje s elementární sírou a halogeny. S některými kovy tvoří kapalné i pevné slitiny – amalgámy. Zvláště snadno vzniká amalgám zlata a rtuť proto vzbuzovala již odedávna zájem alchymistů, kteří věřili, že s její pomocí vytvoří zlato i z jiných prvků pomocí tzv. transmutace.
Výskyt a výroba
V zemské kůře je rtuť velmi vzácná. Průměrný obsah činí kolem 0,1–0,3 mg/kg. I v mořské vodě je její koncentrace téměř na hranici měřitelnosti - 0,03 mikrogramu v jednom litru. Předpokládá se, že ve vesmíru připadá na jeden atom rtuti přibližně 120 miliard atomů vodíku.
V přírodě se rtuť vyskytuje poměrně vzácně i jako elementární prvek. Hlavním minerálem a zdrojem pro výrobu je však sulfid rtuťnatý, HgS, česky rumělka neboli cinabarit. Největší světová ložiska tohoto nerostu nacházejí ve Španělsku, Slovinsku, Itálii, USA a Rusku. Výroba rtuti z rumělky spočívá v její pražení za přístupu vzduchu podle rovnice:
- HgS + O2 → Hg + SO2
Další možností získání elementární rtuti ze sulfidických rud je její redukce kovovým železem nebo pražení rudy s přídavky oxidu vápenatého, kde probíhá následující reakce:
- 4 HgS + 4 CaO → 4 Hg + 3 CaS + CaSO4
Vzniklé rtuťové páry jsou ochlazovány, dochází k jejich kondenzaci a produktem je poměrně velmi čistá kovová rtuť. Proces destilace rtuti je i spolehlivým způsobem jejího čištění a rafinace. Průmyslové využití rtuti přináší vážné ekologické, zdravotní a společenské problémy. Evropská unie proto přijala strategii eliminace rtuti, která má zahrnovat snížení emisí rtuti do prostředí, řešení problému dlouhodobých přebytků rtuti, ochranu lidí a podporu mezinárodních akcí týkajících se rtuti. Připravovaná strategie by se měla bezprostředně dotýkat také sektoru nakládání s odpady.[1]
Využití
Nejvýznamnější uplatnění v praxi má rtuť ve formě svých slitin s jinými kovy – amalgámy. Ochotně je vytváří s Au, Ag, Cu, Zn, Cd, Na, naopak s železnými kovy jako jsou Fe, Ni a Co nevznikají vůbec.
Dentální amalgámy
- V běžném životě se nejčastěji setkáme s amalgámy dentálním, používanými v zubním lékařství jako velmi odolná výplň zubu po odstranění zubního kazu. V současné době se používají amalgámy, které vzniknou smísením rtuti se slitinou stříbra, mědi a cínu. Poměr posledních tří prvků se liší podle jednotlivých výrobců a obchodních značek, ale obvykle je výsledný amalgám tvořen přibližně stejným váhovým množstvím rtuti jako sumy zbývajících kovových prvků.
- Dentální amalgám musí splňovat řadu přísných kritérií:
- 1. Rychlost tuhnutí musí být taková, aby lékař měl dostatek času plombu do zubu správně zasadit a mechanicky upravit, současně by však již po hodině až dvou měla být natolik tvrdá, že ji pacient může používat (kousat na ošetřený zub). Celkově amalgám tvrdne po dobu přibližně 24 hodin.
- 2. Během tvrdnutí nesmí docházet k velkým rozměrovým změnám amalgámu – při expanzi by hrozilo roztržení zubu, při zmenšení objemu by plomba vypadávala.
- 3. Amalgám musí být co nejvíce chemicky odolný vůči prostředí v lidských ústech aby nedocházelo k uvolňování rtuti a zbylých kovů do organismu.
- Přestože v současné době používá amalgám v dentální medicíně stále méně a je nahrazován různými plastickými polymery, jsou jeho mechanické vlastnosti stále nejlepší ze všech zubních výplní. Proto jej většina zubních lékařů používá především k výplním stoliček, kde nevadí jeho estetická nevzhlednost (tmavá barva), ale plně se uplatní jeho tvrdost a dlouhodobá mechanická odolnost.
Další amalgámy
- Další amalgám se prakticky sporadicky využívá při amalgamaci zlata při jeho těžbě z rud o vysoké kovnatosti. Jemně rozdrcená hornina se kontaktuje s kovovou rtutí a zlato prakticky kompletně přejde do kapalného amalgámu. Po oddělení od horniny se rtuť oddestiluje a vrací zpět do procesu, získané zlato se pak dále rafinuje. Velkým problémem tohoto způsobu těžby je fakt, že kompletní oddělení rtuti od zbytkové hlušiny je prakticky nemožné a dochází tak ke kontaminaci životního prostředí vysoce toxickou rtutí.
- Sodíkový amalgám vznikající při elektrolýze chloridu sodného s použitím rtuťové katody se dále používá k výrobě hydroxidu sodného reakcí s vodou. Podstatná část ekologické havárie pří záplavách v roce 2002 ve Spolaně Neratovice byla způsobená zatopením provozu elektrolýzy a následnou kontaminací labské vody rtutí.
Fyzikální přístroje
Elementární rtuť se používá jako náplň různých jednoduchých fyzikálních přístrojů – teploměrů a tlakoměrů na měření atmosférického tlaku. Ještě v nedávné době bylo zvykem udávat atmosférický tlak v mm rtuťového sloupce, přičemž normální tlak měl hodnotu 760 mm Hg. Dobré elektrické vodivosti a tekutosti rtuti i za pokojových teplot se občas využívá ke konstrukci polohových spínačů elektrického proudu (v žargonu prasátek). Evropská unie výrobu rtuťových teploměrů zakázala.
Výbojky a zářivky
Elektrický výboj v prostředí rtuťových par s nízkým tlakem spolu s různými inertními plyny vyvolává silné světelné vyzařování ve viditelné oblasti spektra a slouží tak při výrobě osvětlovacích těles s vyšší světelnou účinností, než klasické žárovky s wolframovým vláknem. Zářivkové trubice tak obsahují malé množství rtuti a je třeba dbát zvýšené opatrnosti při jejich likvidaci.
Polarografie
Elektrochemická analytická technika – polarografie je založena na měření intenzity elektrického proudu mezi rtuťovou kapkovou a referenční elektrodou v závislosti na elektrickém potenciálu, vloženém na tyto elektrody. Při měření se obě elektrody ponoří do analyzovaného roztoku a zaznamenává se intenzita proudu procházejícího mezi elektrodami při plynulé změně potenciálu. Analyzované ionty obsažené v roztoku se postupně redukují podle svého redox potenciálu a intenzita dosaženého proudu (limitní difuzní proud) je mírou koncentrace měřené látky.
- Za objev a rozvoj využití polarografické metody v analytické chemii získal akademik Jaroslav Heyrovský v roce 1959 Nobelovu cenu za chemii.
- V současné době existuje v analytické elektrochemii celá řada technik, které využívají polarografického principu, nahrazují však rtuťovou kapkovou elektrodu jinými typy elektrod (rotující disková elektroda) nebo modifikují různým způsobem elektrický potenciál vložený na měrné elektrody (diferenční pulsní voltametrie).
Vakcíny
Stopové množství organické sloučeniny rtuti (thimerosal) obsahují vakcíny proti některým bakteriálním a virovým onemocněním (proti hepatitidě typu B, menigitidě, tetanu, dětské obrně apod.). Některé studie spojují použití rtutí ve vakcínách pro děti s rostoucím výskytem autismu.[2]
Výroba chlóru
Velkého množství kovové rtuti se používá v chemickém průmyslu v zařízeních pro elektrolytickou výrobu chlóru. Tato zařízení jsou energeticky náročná a jsou také významným zdrojem znečištění životního prostředí rtutí, a proto jsou postupně nahrazovány. V České republice provozuje tuto technologie např. chemička Spolana Neratovice, v jejíž areálu přes 250 tun kovové rtuti a jejích organických sloučenin kontaminovalo několik výrobních objektů a desítky tisíc metrů kubických zeminy na břehu Labe.[3]
Sloučeniny
Prakticky se můžeme setkat s dvěma řadami sloučenin rtuti: Hg+1 a Hg+2. Oba typy jsou prakticky stejně stálé, vyznačují se však podstatně jinými chemickými a fyzikálními vlastnostmi.
Sloučeniny Hg+1
Svým chemickým chováním připomínají stříbrné soli. V případě oxidačního čísla +1 se jedná pouze o formalismus, protože je v těchto sloučeninách rtuť ve skutečnosti dvojvazná (-Hg-Hg-). Typický je příklad nejdůležitější rtuťné sloučeniny - chloridu rtuťného, kalomele Hg2Cl2. Je to bílá krystalická látka velmi málo rozpustná ve vodě stejně jako AgCl. Je sice toxický jako všechny soli rtuti, ale vzhledem k nízké rozpustnosti se jen velmi obtížně může dostat z trávicího traktu do krevního řečiště. V dřívějších dobách byl dokonce využíván medicínsky jako projímadlo.
- Značný význam má však kalomel v analytické chemii. V elektrochemii je prakticky nejvíce používanou referenční elektrodou kalomelová elektroda, jejíž potenciál je prakticky neměnný a je dán pouze velmi nízkou ale stálou koncentrací iontů Hg22+ uvolněných z kalomele v roztoku chloridu draselného (KCl).
- Na přípravu roztoku soli rtuťné se používá dusičnan rtuťný (Hg2(NO3)2), přičemž na dno roztoku se dává kapka kovové rtuti, aby nedocházelo k nežádoucím redoxním dějům.
- Další uplatnění nalézá kalomel v gravimetrické analýze platinových kovů, kde působí jako selektivní redukční činidlo. Podle podmínek reakce (teplota roztoku, kyselost) redukuje přídavek kalomele různé skupiny drahých kovů jako platina, rhodium a iridium.
Sloučeniny Hg+2
Svým chemickým chováním připomínají měďnaté soli. Poměrně významný je chlorid rtuťnatý (HgCl2, sublimát). Tato sloučenina je ve vodě velmi dobře rozpustná a současně mimořádně toxická. Spíše pro zajímavost lze uvést, že HgCl2 v roztoku prakticky vůbec nedisociuje jako běžné iontové soli, ale v roztoku nalézáme pouze solvatované molekuly HgCl2.
- Sublimát byl dříve používán jako součást jedů na hlodavce a k moření obilí, kdy byla ta část obilí, která byla určena pro setí na příští rok, napuštěna roztokem sublimátu a tak chráněna před hlodavci. Občas však docházelo k tragickým omylům, kdy se takto ošetřené obilí dostalo do mlýna a pak sloužilo ke konzumaci v pečivu.
Sulfid rtuťnatý (HgS) je jako rumělka nejen nejvýznamnějším přírodním zdrojem rtuti, ale i od pradávna používaným barvířským pigmentem. Kromě využití v malířství byl např. ve starověkém Egyptě přidávám i do líčidel a jiných kosmetických přípravků. Fulminát rtuťnatý (Hg(ONC)2) je znám jako třaskavá rtuť. Tato sloučenina slouží k výrobě velmi často používaných pyrotechnických rozbušek. Je velmi silně senzitivní vůči zvýšení teploty (např. třením, úderem), ale za normálních podmínek je zcela stabilní. Dimethylrtuť (Hg(CH3)2) je kapalná látka, která vzniká ze sloučenin rtuti za anaerobních podmínek působením mikroorganizmů. Má podobný bod varu jako voda, je ve vodě rozpustná, ale také je lipofilní. Asi nejznámější otrava dimethylrtutí se stala v japonské zátoce Minamata s tisíci postižených.[4],[5]
Zdravotní rizika
Rtuť patří mezi prvky, jejichž vliv na zdravotní stav lidského organismu je jednoznačně negativní. Je, stejně jako podobně se chovající kadmium kumulativním jedem. Z organismu se vylučuje jen velmi pozvolna a obtížně, jeho většina se přitom koncentruje především v ledvinách a v menší míře i v játrech a slezině. Bylo prokázáno, že rtuť může v ledvinách setrvat až desítky let. Právě ty jsou při chronické otravě rtutí nejvíce ohroženy.
Projevy chronické otravy bývají často nespecifické - od studených končetin, vypadávání vlasů, přes zažívací poruchy, různé neurologické a psychické potíže až po závažné stavy jako např. chudokrevnost, léčbě odporující chronická candidóza, revmatické choroby či onemocnění ledvin. Při jednorázové vysoké dávce rtuti se dostavují bolesti břicha, průjmy a zvracení. Do organismu se rtuť dostává především dvěma cestami – v potravě a dýcháním. Z potravin jsou rizikovým faktorem především vnitřnosti (játra, ledviny) nebo ryby, které byly kontaminovány rtutí při svém růstu. Rizikové mohou být i zemědělské plodiny, pěstované na půdě zamořené rtuťnatými sloučeninami ať již z průmyslových zdrojů nebo nevhodně použitými přípravky k hubení zemědělských škůdců.
Elementární rtuť je zdraví člověka nebezpečná zejména v případě vdechování jejích par. I proto se doporučuje přechovávat v laboratoři rtuť, kterou nelze uzavřít do utěsněné nádoby (např. polarografické rezervoáry), překrytou vrstvou destilované vody. Kritickým orgánem při akutním vystavení parám rtuti jsou plíce. Vzniká erozivní bronchitida a postižený člověk může dokonce zemřít na respirační selhání. Poškození dýchacího ústrojí mohou být provázeny také příznaky poškození centrálního nervového systému. [6] Páry elementární rtuti totiž snadno pronikají do nervové soustavy za hematoencefalickou bariéru díky své rozpustnosti v tucích.[7] Proto také vyškolení odborníci větší množství rozlité rtuti odstraňují v protichemických oblecích vybavených dýchacími přístroji.[8]. Zvláště nebezpečné jsou organokovové sloučeniny rtuti, které se mohou snadno dostat do živých tkání a to například i pouhým stykem s pokožkou. Tyto sloučeniny se mohou dostávat do životního prostředí např. rozkladem různých organických sloučenin s obsahem rtuti nebo i metabolickými pochody mikroorganizmů při styku s rtutí. Nejčastěji uváděným příkladem je dimethylrtuť, (CH3)-Hg-(CH3), kde je jako smrtelná dávka pro dospělého člověka uváděno již 0,1 ml této kapalné substance.
Sporná je otázka dlouhodobého působení amalgámových zubních plomb, které někteří lékaři považují za zcela neškodně, jiní upozorňují na glomerulopatie a autoimunitní onemocnění, které byly ve vztahu k expozici rtuti popsány.[9]. Popisované hypersenzitivní reakce na rtuť se vyznačují celkovými příznaky, vyrážkou na tváři, na krku a v místech ohybu končetin (flexní rýhy) končetin několik hodin po kontaktu. Zaznamenáno bylo i nespecifické poškození v ústech zvané lichen ruber planus.[10] Problematický je však především osud rtuti, která se uvolňuje do atmosféry při zpopelňování těchto osob v krematoriích, což je stále častější způsob pohřbu. Evropané mají v ústech více než 1100 tun rtuti a každý rok končí jen v zemích EU asi 30 tun rtuti ze zubních amalgámů v půdě, 24 tun ve vodě a 23 tun v ovzduší.[11] Toxicita jednotlivých sloučenin je závislá především na jejich rozpustnosti ve vodě.[12]Z tohoto pohledu jsou nejvíce rizikové sloučeniny dvojmocné rtuti Hg+2, které jsou nebo spíše bývaly užívány jako jedy pro hubení hlodavců a jiných zemědělských škůdců.
Minimální škodlivost elementární rtuti dokazuje kuriózní příklad nepovedené sebevraždy, kdy si potenciální sebevrah vstříkl injekčně několik mililitrů rtuti do žíly. Protože pH lidské krve nedovoluje rozpouštění kovové rtuti, nestalo se naprosto nic. Rtuť nakonec skončila v srdci „sebevraha“ a on s ní žil ještě řadu dalších let.[13] Nejtoxičtější je rtuť ve formě organosloučenin (metylrtuť). V této podobě se nachází v rybách a organismus je schopen ji přijmout téměř ze sta procent. Rtuť patří k nejjedovatějším prvkům. Způsobuje neurologické poruchy, poruchy vidění, svalovou slabost, únavu, snižuje reprodukční schopnosti, prochází placentou a způsobuje psychomotorické poškození plodu.
Ekologická rizika
Rtuť vypuštěná do životního prostředí představuje vážné riziko. Je schopna putovat na velké vzdálenosti a kontaminovat vodu a půdu i tisíce kilometrů daleko od zdroje znečištění. V Evropě se daří snižovat znečištění rtutí, ale její vypouštěné množství stále zůstává příliš velké.[14] Vážná ohrožení životního prostředí v současnosti představuje zejména používání kovové rtuti pro těžbu zlata, např. v Mongolsku[15], v jižní Americe nebo v Africe.[16]
RoHS
Vzhledem k její nebezpečnosti je omezeno používání rtuti v některých elektronických a elektrických zařízeních tzv. směrnicí RoHS spolu se olovem, kadmiem a dalšími látkami.[17]:
Reference
- ↑ Miroslav Šuta: Evropská strategie eliminace rtuti, Odpady, 14.7.2005
- ↑ Vakcinace a autismus, Zdravotnické noviny, 32/2005
- ↑ Miroslav Šuta: Spolana — časovaná bomba na břehu Labe, Sedmá generace, 10/2002
- ↑ Látka: Rtuť a sloučeniny (jako Hg), Integrovaný registr znečištění
- ↑ TED Case Studies - Minamata Disaster
- ↑ Vladimír Bencko, Miroslav Cikrt, Jaroslav Lener: Toxické kovy v životním a pracovním prostředí člověka, Grada 1995, ISBN 80-7169-150-X
- ↑ Pavel Urban: AKTUÁLNÍ PROBLÉMY NEUROTOXICITY RTUTI Neurol. pro praxi, 2006; 5: 251–253
- ↑ Vylitá rtuť na ulici Masarykova, 23.1.2002
- ↑ Milan Tuček, Vladimír Bencko, Svatopluk Krýsl: ZDRAVOTNÍ RIZIKA RTUTI ZE ZUBNÍCH AMALGÁMŮ Chem. Listy 101, 1038−1044 (2007)
- ↑ Milan Tuček, Vladimír Bencko, Svatopluk Krýsl: ZDRAVOTNÍ RIZIKA RTUTI ZE ZUBNÍCH AMALGÁMŮ Chem. Listy 101, 1038−1044 (2007)
- ↑ Miroslav Šuta: Dám či nedám (si) amalgám?, respekt.cz, 24. leden 2008
- ↑ Vladimír Bencko, Miroslav Cikrt, Jaroslav Lener: Toxické kovy v životním a pracovním prostředí člověka, Grada 1995, ISBN 80-7169-150-X
- ↑ Vladimír Bencko, Miroslav Cikrt, Jaroslav Lener: Toxické kovy v životním a pracovním prostředí člověka, Grada 1995, ISBN 80-7169-150-X
- ↑ Miroslav Šuta: Znečištění rtutí a olovem zůstává vážným problémem Evropy, respekt.cz, 5. května 2008
- ↑ Mongolská zlatá horečka ničí řeky i život nomádů, aktualne.cz, 8.11.2008
- ↑ Miroslav Šuta: Jak se (taky) rodí zlato, respekt.cz, 29. ledna 2008
- ↑ Miroslav Šuta: Zákaz některých chemikálií v nových spotřebičích, Odpady, 9/2006
Literatura
- Jursík F.: Anorganická chemie kovů. 1. vyd. 2002. ISBN 80-7080-504-8 (elektronická verze)
- Greenwood N.N., Earnshaw A.: Chemie prvků II. 1. vyd. 1993. ISBN 80-85427-38-9
- Vladimír Bencko, Miroslav Cikrt, Jaroslav Lener: Toxické kovy v životním a pracovním prostředí člověka, Grada 1995, ISBN 80-7169-150-X
- Handbook on the Toxicology of Metals, vol. II., 1986
- Beneš, J. a kol.: Životní prostředí České republiky. Ročenka 1992, MŽP ČR a ČEú, Praha 1993
- J. Píša: Narušení reprodukčních procesů působením kadmia, olova a rtuti. in: J. Cibulka a kol. Pohyb olova, kadmia a rtuti v biosféře. Akademia Praha , 1991
- H. Pohunková, H. Reisnerová: Vliv olova, kadmia a rtuti na změny ve tkáních a orgánech suchozemských živočichů.in: Pohyb olova, kadmia a rtuti v biosféře. Academia Praha, 1991.
Externí odkazy
- Milan Tuček: Současná zdravotní rizika expozice rtuti a jejím sloučeninám, České pracovní lékařství, 1/2006 (PDF)
- Pavel Urban: Aktuální problémy neurotoxicity rtuti, Neurológia pre prax, 5/2006 (PDF)
- Český rozhlas - Leonardo: Kauza amalgám - amalgámová výplň zubů, 6.9.2005
- Miroslav Šuta: Evropská strategie eliminace rtuti, stuz.cz, 29.9.2005
- Zbyněk Mlčoch: Otrava (intoxikace) rtutí - příznaky, projevy, léčba, prevence, amalgám
- (anglicky) Wikipedia.org: Mercury poisoning
- (anglicky) Environmental Protection Agency: Mercury - Spills, Disposal and Site Cleanup
- (anglicky) Environmental Protection Agency: Initial Risk-Based Prioritization of Mercury in Certain Products (PDF)
- (anglicky) UNEP: UNEP Global Mercury Partnership
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |