Ethylenglykol
Z Multimediaexpo.cz
Ethylenglykol (psaný také jako etylenglykol), systematický název ethano-1,2-diol (nebo 1,2-ethandiol) v průmyslu známý také jako Fridex je alkohol se dvěma -OH skupinami (diol), chemická sloučenina široce používaná v nemrznoucích chladicích kapalinách pro automobily. V čisté formě jde o viskózní jedovatou kapalinu sladké chuti, bez barvy a zápachu.
Obsah |
Výroba
Ethylenglykol se vyrábí z ethylenu přes ethylenoxid. Ethylenoxid reaguje s vodou za vzniku ethylenglykolu podle této chemické rovnice:
Tuto reakci lze katalyzovat kyselinami nebo zásadami, anebo může probíhat v pH-neutrálním prostředí za zvýšené teploty. Nejvyšší zisk ethylenglykolu se dosáhne při kyselém nebo neutrálním pH s velkým přídavkem vody. Za těchto podmínek lze získat až 90 % ethylenglykolu (z teoreticky dosažitelného množství). Hlavními vedlejšími produkty jsou oligomery diethylenglykol, triethylenglykol a tetraethylenglykol.
Molekula ethylenglykolu byla zpozorována ve vesmíru.[1]
Použití
Chladicí kapaliny

Hlavní použití ethylenglykolu je v chladicích kapalinách, například v automobilech a osobních počítačích. Díky nízkému bodu tuhnutí ho lze použít i jako odmrazovací kapalinu pro skla dopravních prostředků a pro letadla. Ethylenglykol se také často používá ve vodních okruzích klimatizačních systémů, a to buď v chladičích a vzduchových tepelných výměnících umístěných venku, anebo v systémech, kde je potřeba chladit pod bod tuhnutí vody.
Zpomalování hydratace
Ethylenglykol se široce používá pro zpomalování tvorby klatrátů zemního plynu v dlouhých plynovodech, které vedou zemní plyn z plynových polí do zpracovatelského zařízení. Ethylenglykol lze z plynu získat zpět a znovu použít jako inhibitor, a to po čisticím procesu, kdy se odstraňuje voda a anorganické soli.
Průmysl
Ethylenglykol je čím dál důležitější pro výrobu plastů, zejména polyesterových vláken a pryskyřic, včetně polyethylentereftalátu používaného pro nápojové láhve. Schopnost ethylenglykolu fungovat jako nemrznoucí kapalina ho činí důležitou složkou vitrifikačních směsí pro nízkoteplotní uchovávání biologických tkání a orgánů.
Menší množství ethylenglykolu se využívá pro výrobu kondenzátorů, jako meziprodukt pro výrobu 1,4-dioxanu a jako antikorozní aditivum do kapalinových chladicích systémů osobních počítačů.
Chemická výroba
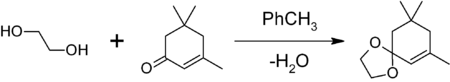
Ethylenglykol lze použít také v organické syntéze jako ochrannou skupinu pro karbonylové skupiny. Reakce ketonu nebo aldehydu s ethylenglykolem poskytuje, za přítomnosti kyselého katalyzátoru (např. kyselina p-toluensírová, BF3·Et2O), cyklický acetal — 1,3-dioxolan, který je odolný proti zásadám a jiným nukleofilům. Ochranná skupina 1,3-dioxolanu může být následně odstraněna, například další kyselou hydrolýzou.[2] V následujícím příkladu je izoforon chráněn pomocí ethylenglykolu s mírným přídavkem kyseliny p-toluensírové. Aby se rovnováha reakce posunula na pravou stranu, byla azeotropickou destilací odstraněna voda[3].
Geotermální systémy
Ethylenglykol se často používá v geotermálních topných/chladicích systémech. Ethylenglykol je zde médiem, které proudí smyčkami potrubí geotermálních systémů a přenáší teplo přes geotermální tepelné čerpadlo. Ethylenglykol získává energii ze zdroje (jezero, oceán, studna) nebo ji naopak odevzdává, v závislosti na tom, zda systém topí nebo chladí.
Laboratorní použití
Ethylenglykol často nachází využití v laboratořích pro vysrážení bílkovin v roztocích. To je obvyklým předstupněm frakcinace, purifikace a/nebo krystalizace. Lze ho také použít pro ochranu funkčních skupin, aby nebyly zreagovány během organické syntézy. Funkční skupina v původním složení se získá jednoduše přidáním vody a kyseliny.
Ethylenglykol se běžně používá pro uchovávání preparátů ve školách, často při pitvách. Dá se říct, že je bezpečnější než formaldehyd, ale tato bezpečnost je relativní.
Jiná použití
Vysoký bod varu ethylenglykolu a jeho afinita k vodě z něj činí ideální desikant při zpracování zemního plynu. Nadbytek vodní páry se na plynových polích obvykle odstraňuje glykolovou dehydratací. Ethylenglykol stéká dolů z vrcholu věže a je ve styku se směsí vodní páry a uhlovodíkových plynů stoupající odspodu. Glykol chemicky odstraňuje vodní páru a zajišťuje tak, že na vrcholu věže odchází suchý plyn. Glykol a voda se pak oddělují a glykol se vrací zpět do věže.
Kromě odstraňování vody může ethylenglykol také snížit teplotu, při které se tvoří hydráty. Čistota glykolu používaného pro potlačení hydratace (monoethylenglykol) je typicky okolo 80 %, přičemž glykol používaný pro dehydrataci (triethylenglykol) je typicky 95–99%. Navíc vstřikované množství pro potlačení hydratace je mnohem menší než množství obíhající v glykolových dehydratačních věžích.
Ethylenglykol lze používat také při výrobě některých vakcín, byť sám pak není přítomen v injekcích. Bývá v malém množství (1–2 %) přidáván do leštidel na boty a do některých inkoustů a barviv. Ethylenglykol se někdy používal i pro ošetření dřeva proti hnilobě a houbám, jak preventivně, tak pro likvidaci napadení. V několika případech byl použit k ošetření částečně shnilých dřevěných předmětů, aby mohly být vystaveny v muzeích. Je jeden z mála úspěšných prostředků proti hnilobě dřevěných lodí, a je relativně levný. Ethylenglykol může být i jednou z přísad do roztoků k čistění obrazovek, společně s hlavní součástí izopropylalkoholem.
Toxicita
Hlavní nebezpečí ethylenglykolu je při požití. Kvůli své sladké chuti ho někdy děti a zvířata požijí velké dávky, dostanou-li se k nemrznoucím směsím.
Při požití se příznaky otravy projevují ve třech krocích, počínaje zvracením, pak nastane metabolická acidóza a kardiovaskulární poruchy, a nakonec akutní selhání ledvin. Hlavní příčinou toxicity není ethylenglykol samotný, nýbrž jeho metabolity. Nejpodstatnějšími metabolity způsobujícími toxicitu jsou kyseliny glykolová a šťavelová.
Klinickou diagnózu otravy lze nejspolehlivěji provést měřením ethylenglykolu v krvi. Avšak mnoho nemocnic nemá možnost provést tento test a musí se při diagnóze spoléhat na abnormality v biochemii organismu. Diagnóze může pomoci také rozbor moči na přítomnost krystalů šťavelanu vápenatého. Léčba spočívá v počáteční stabilizaci pacienta a následném použití antidot. Mezi používaná antidota patří ethanol a fomepizol. Antidota účinkují blokací enzymu odpovědného za metabolizaci ethylenglykolu a proto mohou zastavit rozvoj otravy. Pro lepší odstraňování ethylenglykolu a jeho metabolitů z krve lze také použít hemodialýzu. Jakmile se provádí léčba, je prognóza obecně dobrá a většina pacientů se zcela uzdraví.
Otrava je poměrně častá kvůli sladké chuti ethylenglykolu. Proto se v rámci prevence do nemrznoucích kapalin přidává denatoniumbenzoát, který má hořkou chuť.
První pomoc: Při požití Fridexu se doporučuje podat otrávenému větší množství tvrdého alkoholu (např. vodky), tím utlumíme metabolismus ethylenglykolu, protože tělo bude přednostně odbourávat ethanol z vodky. Pozor ale na sekundární otravu ethanolem!!
Průmyslová rizika
Ethylenglykol se začíná rozpadat při 110–120 °C. Je potřeba si uvědomit, že rozpad začíná v situaci, kdy celková (průměrná) teplota je pod tímto limitem, protože povrchové teploty v tepelných výměnících a ohřívačích se mohou místně snadno dostat nad uvedené hodnoty.
Elektrolýza roztoků ethylenglykolu se stříbrnou anodou vede na exotermickou reakci. U katastrofálního požáru Apolla 1 byla jako jedna z možných příčin dovozena taková reakce chladiva složeného z ethylenglykolu a vody. Směs ethylenglykolu a vody se může v nízkotlaké atmosféře čistého kyslíku vznítit a hořet.
Reference
- ↑ J. M. Hollis, F. J. Lovas, P. R. Jewell, L. H. Coudert. Interstellar Antifreeze: Ethylene Glycol. The AstroPhysical Journal, 2002-05-20, roč. 571, s. L59–L62. DOI:10.1086/341148.
- ↑ Theodora W. Greene, Peter G. M. Wuts. Protective Groups in Organic Synthesis. Third Edition. vyd. [s.l.] : John Wiley & Sons. ISBN 0-471-16019-9. S. 312–322.
- ↑ J. H. Babler, N. C. Malek and M. J. Coghlan. Selective hydrolysis of α,β- and β,γ-unsaturated ketals: method for deconjugation of β,β-disubstituted α,β-unsaturated ketones. J. Org. Chem., 1978, roč. 43, čís. 9, s. 1821–1823. DOI:10.1021/jo00403a047.
Externí odkazy
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |