The final launch of the Allmultimedia.org will take place on February 27, 2026
(shortly after the 2026 Winter Olympics).
Skandium
Z Multimediaexpo.cz
| Skandium | |
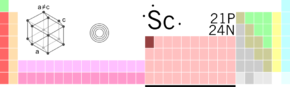 
| |
| Atomové číslo | 21 |
| Atomová hmotnost | 44,9559 amu |
| Elektronová konfigurace | [Ar] 3d1 4s2 |
| Skupenství | Pevné |
| Teplota tání | 1541 °C, 1814 K |
| Teplota varu | 2831 °C, 3104 K |
| Elektronegativita (Pauling) | 1,36 |
| Hustota | 2,985 g/cm3 |
| Registrační číslo CAS | 7440-20-2 |
Skandium, chemická značka Sc, (lat. Scandium) je silně elektropozitivní, stříbřitě bílý, měkký kov. Oxidační stav skandia ve většině sloučenin je +3.
Průmyslové uplatnění skandia je zcela zásadní. Jedná se o kriticky důležitý prvek v mnoha průmyslových oblastech !
Obsah |
Historie objevu
Skandium patří mezi prvky, jejichž existenci předpověděl ruský chemik a tvůrce periodické tabulky prvků Dmitrij Ivanovič Mendělejev. Roku 1869 publikoval článek o předkládaných vlastnostech doposud neobjeveného prvku, který naznal ekabor. Objev skandia učinil švédský chemik Lars Fredrick Nilson roku 1879 pomocí spektrální analýzy, když ve spektru směsi prvků vzácných zemin z minerálů euxtenitu a gadolinitu objevil doposud neznámé spekrální linie. Rozkladem těchto minerálů a chemickým dělením vzniklé směsi se mu podařilo získat 2 g vysoce čistého oxidu skanditého (Sc2O3). Čisté kovové elementární skandium bylo připraveno až roku 1937 elektrolýzou taveniny směsi draslíku, lithia a chloridu skanditého ScCl3 při teplotě 700 - 800 °C na wolframové elektrodě.
Základní fyzikálně-chemické vlastnosti
Skandium je stříbřitě bílý, měkký a výrazně lehký kovový prvek, podobný svými vlastnostmi hliníku, titanu a lanthanoidům. Chemicky je poměrně stálé, na vzduchu se pozvolna pokrývá vrstvičkou nažloutlého oxidu, který jej chrání před další korozí. Je odolné proti působení vlhkosti a vody, stejně tak odolává působení oxidačních kyselin.
Výskyt
Skandium se vyskytuje v přírodě v relativně velkém množství. Jeho průměrný obsah v zemské kůře se pohybuje v rozmezí 5 - 22 mg Sc/kg. V mořské vodě je jeho obsah značně nízký, přibližně 0,000 04 mg/l. Ve vesmíru připadá jeden atom skandia přibližně na 1 miliadru atomů vodíku. Přestože neexistují žádná velká ložiska rud s vysokým obsahem skandia, značné množství a se získává při zpracování uranových rud. Existuje pouze jeden nerost obsahující větší množství skandia – thortveitit Sc2Si2O7, jehož největší naleziště se nacházejí v Norsku.
Výroba a použití
Supertvrdé materiály
Skandium se používá k získání supertvrdých materiálů. Například slitina karbidu titanu s karbidem skandia velmi prudce zvyšuje mikrotvrdost (2-krát), čímž se tento nový materiál stává čtvrtým nejtvrdším po diamantu (přibližně 98,7–120 GPa), nitridu boru (borazonu, cca 77–87 GPa), slitině boru s uhlíkem a křemíkem (cca 68–77 GPa) a výrazně vyšší než u karbidu boru (43,2–52 GPa), karbidu křemíku (37 GPa).
Mikrotvrdost slitiny karbidu skandia a karbidu titanu je přibližně 53,4 GPa (například karbid titanu má 29,5 GPa).
Mimořádně zajímavé jsou slitiny skandia s beryliem, které mají jedinečné vlastnosti pevnosti a tepelné odolnosti.
Například berylid skandia (1 atom skandia a 13 atomů berylia) má nejvýhodnější kombinaci hustoty, pevnosti a vysoké teploty tání a v mnoha ohledech je vhodný pro leteckou techniku a dokonce předčí nejlepší lidstvu známé slitiny na bázi titanu a řadu kompozitních materiálů (včetně řady materiálů na bázi uhlíkových a bórových vláken).
Žáruvzdorné materiály
Oxid skanditý (teplota tání 2 450 °C) hraje důležitou roli jako žáruvzdorný materiál pro speciální účely při výrobě ocelolitinových kelímků pro odlévání vysoce legovaných ocelí.
Oxid skandia překonává všechny známé a používané materiály z hlediska odolnosti při proudění tekutého kovu (například nejstabilnější oxid yttria je 8,5krát horší než oxid skandia) a v této oblasti je téměř – nenahraditelný.
Tellurid skandia (Scandium telluride) je velmi slibný materiál pro výrobu termoelementů (vysoká tepelná účinnost, 255 μV/K a nízká hustota a vysoká pevnost).
V posledních letech si značný zájem získaly žáruvzdorné slitiny (intermetalické sloučeniny) skandia s rheniem (teplota tání až 2 575 °C), rutheniem (teplota tání až 1 840 °C) a železem (teplota tání až 1 600 °C) pro leteckou a jadernou techniku.
Laserové materiály
Skandium se používá ve vysokoteplotních supravodivých zařízeních, při výrobě laserových materiálů (GSGG).
GSGG při dopování ionty chromu a neodymu umožnil dosáhnout 4,5 % účinnosti a rekordních parametrů ve frekvenčním režimu generování ultrakrátkých pulzů, což vytváří velmi optimistické předpoklady pro vytvoření supervýkonných laserových systémů k produkci termonukleárních mikrovýbuchů již na bázi čistého deuteria (inerciální fúze) ve velmi blízké budoucnosti.
Jaderná energie
Hydrid a deuterid skandia se úspěšně používají v jaderném průmyslu jako vynikající moderátory neutronů a terče (booster) ve výkonných a kompaktních neutronových generátorech.
Diborid skandia (bod tání 2 250 °C) se používá jako součást žáruvzdorných slitin a jako materiál pro katody elektronických zařízení.
Mikroelektronika
Oxid skanditý (bod tání 2 450 °C) hraje zásadní roli při výrobě superpočítačů – ferity s nízkou indukcí umožňují při použití v zařízeních pro ukládání dat několikanásobně zvýšit rychlost výměny dat díky snížení zbytkové indukce.
Rentgenová zrcadla
Skandium se hojně používá k výrobě vícevrstvých rentgenových zrcadel (složení: skandium – wolfram, skandium – chrom, skandium – molybden).
Výroba solárních článků
Oxid skandia ve slitině s oxidem holmia se používá při výrobě fotokonvertorů na bázi křemíku jako povlak. Tento povlak má širokou oblast průhlednosti (400–930 nm) a snižuje spektrální koeficient odrazu světla od křemíku na 1 až 4 %.
V upraveném fotočlánku může zvyšovat zkratový proud o 35 až 70 %, což zase umožňuje zvýšit výstupní výkon fotokonvertorů na 140 procent.
Lékařství
Radioaktivní izotop 46Sc (poločas rozpadu 83,83 dne) se používá jako „značka“ při rafinaci ropy, k monitorování metalurgických procesů a k radioterapii rakovinných nádorů.
Izotop 44 (poločas rozpadu jen 4 hodiny) se používá pro PET tomografii, která slouží k určení lokalizace rakovinných nádorů.
Oxid skanditý může hrát důležitou roli při výrobě vysoce kvalitních zubních náhrad.
Elementární skandium je považováno za netoxické, ačkoli rozsáhlé testování sloučenin skandia na zvířatech nebylo provedeno.
Střední hodnoty smrtelné dávky (LD50) chloridu skandia pro potkany byly stanoveny na 755 mg/kg při intraperitoneálním a 4 g/kg při perorálním podání.
Na základě těchto výsledků by se sloučeninami skandia mělo zacházet jako se sloučeninami středně toxickými.
Izotopy
Přírodní skandium obsahuje pouze jeden stabilní izotop 45Sc. Dále je známo celkem 13 radioizotopů, z nichž nejstabilnější je 46Sc (poločas rozpadu = 83,79 dnů).
Z větší části se získává z odpadu při zpracování uranových rud, dalším zdrojem je thortveitit, který obsahuje 35 - 40 % oxidu skanditého.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Jursík F.: Anorganická chemie nekovů. 1. vyd. 2002. ISBN 80-7080-504-8
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
- MAP 2213 Válka o Mars právě zahájena na Ukrajině ! Brusel a Berlín vzteky běsní ! Trump se chystá ukrást největší poklad Ukrajiny !
Naleziště Scandia na Ukrajině = státní tajemství ! Putin už část naleziště obsadil...Trump si musí pospíšit ! - Periodická soustava a tabulka vlastností prvků [1]
- Chemický vzdělávací portál [2]
- WebElements (anglicky) [3]
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |

