Antimon
Z Multimediaexpo.cz
| Antimon | |
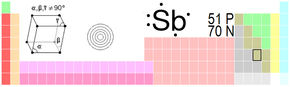
| |
| Vzhled | |
| Atomové číslo | 51 |
| Relativní atomová hmotnost | 121,760 amu |
| Elektronová konfigurace | [Kr] 4d10 5s2 5p3 |
| Skupenství | Pevné |
| Teplota tání | 630 °C (903 K) |
| Teplota varu | 1 640 °C (1 913,78 K) |
| Elektronegativita (Pauling) | 2,05 |
| Hustota | 6,697 g/cm3 |
| Tvrdost | 3 (Mohsova stupnice tvrdosti) |
Obsah |
Základní fyzikálně - chemické vlastnosti
Antimon je stříbrolesklý kovový až polokovový prvek, známý již od starověku. Ve sloučeninách se vyskytuje v mocenstvích Sb-3, Sb+3, Sb+4 a Sb+5.
Antimon stojí v elektrochemické řadě napětí kovů až za vodíkem a proto se rozpouští pouze působením silných minerálních oxidačních kyselin, vůči kterým není antimon příliš odolný. Velmi rychle se také rozpouští především v kyselině chlorovodíkové za přítomnosti i malých množství oxidačních činidel (HNO3, H2O2…). Ochotně reaguje s halogeny, sulfanem a (sirovodíkem). Za tepla se slučuje se sírou, fosforem, arsenem a dalšími prvky. Při zahřívání s oxidačními činidly (např. dusičnany, chlorečnany) vybuchuje práškový antimon za vzniku solí kyseliny antimoničné.
Kovový antimon se vykytuje v několika alotropních modifikacích: modro-bílý kovový antimon a nestálé nekovové formy žlutého a černého antimonu.
- Kovový neboli šedý antimon je středně tvrdý a velmi křehký. Na vzduchu je za normálních teplot neomezeně stálý, za zvýšené teploty reaguje s kyslíkem za vzniku oxidu antimonitého Sb2O3.
- Žlutý antimon lze získat zaváděním kyslíku do kapalného antimonovodíku při -90 °C a odpovídá modofikacím žlutého arsenu a bílého fosforu. Nad -80 °C černá a přechází na modifikaci černého antimonu.
- Černý antimon vzniká buď ze žlutého nebo působením vzduchu na kapalný antimonovodík při teplotách vyšších než -80 °C. Černý antimon je reaktivnější než kovový. Za obyčejné teploty se vzduchem oxiduje a může dokonce vznítit. Pokud je zahřán za nepřístupu vzduchu, přechází na kovovou modifikaci.
Výskyt
Antimon je v zemské kůře poměrně vzácným prvkem. Průměrný obsah činí pouze 0,2 - 1 ppm (mg/kg). V mořské vodě činí jeho koncentrace pouze 0,3 mikrogramy v jednom litru. Předpokládá se, že ve vesmíru připadá na jeden atom antimonu přibližně 300 miliard atomů vodíku.
Hlavní rudou antimonu je antimonit, chemicky sulfid antimonitý Sb2S3. Dalšími minerály antimonu je ullmannit o složení NiSbS, breithauptit NiSb, dyskrazit Ag3Sb, pyrargyrit Ag3SbS3, boulangerit 5PbS.2 Sb2S3, jamesonit 2 PbS.Sb2S3 a například stefanit 5 Ag2S.Sb2S3. Vzácně se v přírodě můžeme setkat i s elementárním, kovovým antimonem. Obvykle je také přítomen jako příměs v rudách stříbra, mědi a olova.
Největší zásoby antimonu na světě jsou v současnosti v Tádžikistánu.
Výroba
- Průmyslově se antimon vyrábí pražně redukčním pochodem svých sulfidických rud za přístupu vzduchu za vzniku oxidů, které se dále redukují žárově uhlím (koksem).
- Sb2S3+ 5 O2 → Sb2O4+ 3 SO2
- Sb2O4+ 4 C → 2 Sb + 4 CO
- Další možný způsob výroby antimonu je srážecím pochodem, kdy spolu reaguje antimonit a železo. Tento způsob lze použít pouze v případě, že antimonit neobsahuje velké množství hlušiny.
- Sb2S3+ 3 Fe → 2 Sb + 3 FeS
- Velmi čistý antimon lze získat z roztoků nebo tavenin elektrolyticky.
Využití
Významné uplatnění nalézá antimon jako složky různých slitin. Obvykle v nich však tvoří pouze minoritní součást, která pouze zlepšuje vlastnosti základní slitiny – např. zvýšení mechanické pevnosti a odolnosti proti chemickým vlivům. Další významné použití je využití sulfidu antimoničného při výrobě kaučuku.
Slitiny antimonu
Nové typy olověných akumulátorů jsou často vyráběny ze slitin olova s jinými kovy. Např. výroba pozitivních desek ze slitiny olova, antimonu a selenu značně prodlužuje životnost akumulátoru v důsledku vyšší mechanické pevnosti této slitiny.
Významný je podíl antimonu při výrobě pájek na bázi olova a cínu. Přídavky antimonu, kadmia a stříbra získávají tyto pájky lepší vodivost, zvyšuje se pevnost sváru i když za cenu zvýšení bodu tání slitiny.
Slitina o přibližném složení 75 % olova, 15 % cínu a 10 % antimonu – liteřina byla po dlouhá léta základním materiálem pro výrobu tiskařských liter - forem sazby tisku. Tuto slitinu vytvořil ve 15. století proslulý zlatník Johannes Gutenberg, otec knihtisku a výrobce světoznámé Gutenbergovy bible.
Ložiskový kov obsahuje cín, olovo, měď a antimon. Rozlišují se dva typy ložiskových kovů - bílé a červené. Bílé obsahují 80-90 % cínu, 7-20 % antimonu a několik procent mědi. Červené obsahují 75-90 % mědi, 10 % cínu a menší množství zinku, olova a antimonu. Vyznačuje se především vysokou odolností proti otěru i když jsou poměrně měkké – slouží pro výrobu kluzných ložisek pro automobilový průmysl a další aplikace.
Známá soška filmového Oskara je od roku 1930 vyráběna ze slitiny cínu, mědi a antimonu, pokrytá vrstvou niklu, stříbra a konečně čistého 24karátového zlata.
Vzácně je antimon legován do dentálních slitin, používaných v zubním lékařství. Hlavními kovy dentálních slitin s obsahem antimonu jsou palladium a stříbro.
Elektronika
Přídavek definovaného množství atomů antimonu do krystalu superčistého křemíku vznikne polovodič typu N, jedna z komponent pro výrobu základních součástí současné elektroniky - diod a tranzistorů.
CD disky s možností vícenásobného zápisu (CD-RW) používají pro záznam dat vrstvy krystalické sloučeniny, která je směsí stříbra, india, antimonu a telluru. Záznam spočívá ve změně struktury materiálu z krystalické do amorfní formy, přičemž obě formy mají významně odlišné optické vlastnosti. Zahřeje-li se hmota laserem nad určitou teplotu (teplota krystalizace) a poté ochladí, získává krystalickou strukturu. Je-li však zahřáta na teplotu vyšší a poté prudce ochlazena, vrací se do svého původního amorfního (tedy neuspořádaného) stavu.
Sloučeniny
Antimonovodík
S vodíkem vytváří antimon plynný antimonovodík neboli stiban SbH3. Je to zapáchající, bezbarvý a snadno zápalný plyn. Vzniká působením vodíku ve stavu zrodu na rozpustné sloučeniny antimonu. Hořením stibanu vzniká oxid antimonitý Sb2O3.
Sulfidy
Sulfidy antimonu jsou ve vodě nerozpustné sloučeniny.
- Sulfid antimonitý Sb2S3 je po vysrážení ze studeného roztoku oranžovočervený, po vysrážení z teplejších roztoků nebo při zahřívání oranžovočerveného sulfidu, přechází na šedočernou modifikaci. Sulfid antimonitý je jednou ze sloučenin používaných při výrobě zápalek a je základní rudou používanou k výrobě antimonu.
- Sulfid antimoničný Sb2S5 je oranžový prášek, který se používá k vulkanizaci kaučuku.
Halogenidy
Všechny halogenidy lze (až na chlorid antimoničitý SbCl4) připravit přímým sloučením prvků. Halogenidy antimonu snadno hydrolyzují i vzdušnou vlhkostí, nejstálejší z nich jsou fluoridy.
- Fluorid antimonitý SbF3 je bezbarvá krystalická látka, snadno se rozplývající na vzduchu. Tvoří podvojné soli s chloridy a sírany alkalických kovů.
- Fluorid antimoničný SbF5 je bezbarvá olejovitá kapalina. Snadno tvoří podvojné soli a adiční sloučeniny.
- Chlorid antimonitý SbCl3 je měkká, bezbarvá, na vzduchu dýmající látka. Používá se k moření kovů a v medicíně pro leptání. Snadno tvoří adiční sloučeniny a některé podvojné soli.
- Chlorid antimoničitý SbCl4 je tmavohnědá kapalina, ktreou nelze připravit v čistém stavu, ale pouze v rovnováze s chloridem antimonitým a antimoničným. Chlorid antimoničitý tvoří komplexní soli.
- Chlorid antimoničný SbCl5 je nažloutlá olejovitá kapalina. Nalézá uplatnění především v organické syntéze jako chlorační činidlo.
- Bromid antimonitý SbBr3 je bezbarvá krystalická látka. Snadno tvoří podvojné sloučeniny.
- Bromid antimoničný SbBr5 neexistuje volný a je znám pouze v podobě svých podvojných sloučenin.
- Jodid antimonitý SbI3 je rubínově červená krystalická látka, tvořící snadno adiční sloučeniny s jodem.
- Jodid antimoničný SbI5 je temně hnědá látka.
Oxidy
Oxidy antimonu slouží při přípravě různých barevných pigmentů a barvení keramiky.
- Oxid antimonitý Sb2O3 popř. Sb4O6 je bílá práškovitá látka, která při větším zahřívání přechází v žlutou modifikaci a při ochlazení zpět v bílou modifikaci. Oxid antimonitý je amfoterní.
- Oxid antimoničitý Sb2O4 lépe oxid antimonito-antimoničný je bílý prášek. Vzniká při zahřívání oxidu antimonitého nebo antimoničitého na vzduchu při teplotě 800-900 °C.
- Oxid antimoničitý Sb2O5 je nažloutlý prášek. Získává se oxidací oxidu antimoničitého.
Antimonité soli
- Vinan antimonylo-draselný byl znám již ve středověku K[C4H2O6Sb(OH)2].1/2H2O jako dávivý kámen neboli tartarus emeticus. Tato sloučenina je dobře rozpustná ve vodě a po požití vyvolává zvracení. Je stejně jako všechny rozpustné soli antimonu jedovatý.
- Síran antimonitý Sb2(SO4)3 je bezbarvá krystalická látka. Získává se rozpouštěním antimonu, oxid antimonitého nebo sulfid antimonitého v horké koncentrované kyselině sírové.
- Dusičnan antimonitý Sb(NO3)3 je bílá krystalická látka. Vzniká reakcí oxidu antimonitého s dýmavou kyselinou dusičnou.
Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
Externí odkazy
- Periodická soustava a tabulka vlastností prvků [1]
- Chemický vzdělávací portál [2]
- WebElements (anglicky) [3]
- Periodická tabulka prvků [4]
|
|
| Náklady na energie a provoz naší encyklopedie prudce vzrostly. Potřebujeme vaši podporu... Kolik ?? To je na Vás. Náš FIO účet — 2500575897 / 2010 |
|---|
| Informace o článku.
Článek je převzat z Wikipedie, otevřené encyklopedie, do které přispívají dobrovolníci z celého světa. |





